Сахарный диабет (СД) 2 типа повышает риск развития инсульта в 3–7 раз, а риск смерти от него в 3–4 раза по сравнению с пациентами без диабета, при этом инсульт на фоне СД отличается более тяжелым течением с быстрой трансформацией зоны пенумбры в зону некроза, даже если изначально очаги поражения были небольшими [1].
Существующие и разрабатываемые соединения с церебропротекторной активностью традиционно изучаются на различных моделях ишемии с использованием животных без премобидного фона (сахарный диабет, артериальная гипертензия и др.).При этом, в условиях клиники, сахарный диабет является одним из распространенных факторов, который не только повышает риск развития, но и значительно усугубляет тяжесть течения инсульта. Поэтому на этапе доклинического исследования целесообразно оценить церебропротекторные свойства исследуемого соединения на животных с экспериментальным СД.
При моделировании сочетанной патологии исследователь непременно сталкивается с проблемой «дозирования» повреждающих факторов, поскольку сахарный диабет, вследствие развивающейся эндотелиальной дисфункции и прокоагулянтных сдвигов в системе гемостаза [2], значительно снижает устойчивость к ишемическому повреждению головного мозга (ГМ). Поэтому для изучения церебропротекторной активности на фоне сахарного диабета необходимо выбрать модель ишемии ГМ и модель СД, которые будут приближены к наиболее часто встречающейся клинической ситуации, а также будут давать возможность информативно оценить тяжесть течения ишемии и динамику патологического процесса на фоне терапии. Целью настоящего исследования является поиск оптимальной продолжительности окклюзии средней мозговой артерии у животных с сахарным диабетом.
Материалы и методы исследования
Исследование проводилось на 120 интактных крысах-самцах массой 280–300 г, в возрасте 6–7 месяцев (питомник лабораторных животных ФГУП ПЛЖ «Рапполово», Санкт-Петербург). Животные содержались в стандартных условиях вивария со свободным доступом к воде и пище. Все манипуляции с животными проводились с учетом правил лабораторной практики, изложенных в «Руководстве по проведению доклинических исследований лекарственных средств», ч. I. (М., 2012) под ред. А.Н. Миронова.
Для исследования нейропротекторных свойств соединений in vivo наиболее часто используется метод моделирования фокальной ишемии ГМ посредством временной внутрисосудистой окклюзии средней мозговой артерии (ОСМА). Подробно описаны 2 метода введения окклюдера во внутреннюю сонную артерию: через внешнюю сонную с последующим восстановлением кровотока по общей сонной (метод LongaE.Z., 1989) и через перфорацию в перманентно перевязанной общей сонной артерии (метод KoizumiJ., 1986). Оба метода обладают сопоставимой воспроизводимостью и по литературным данным не имеют значимых различий по тяжести ишемического повреждения головного мозга (размер инфаркта и возникающие неврологические нарушения) при воспроизведении этих двух методов [8,9]. При этом выполнение ОСМА по методу Longa занимает по времени 30–40 минут, а по методу Koizumi – 15–20 минут.
В качестве модели экспериментальной ишемии ГМ была выбрана временная окклюзия средней мозговой артерии по методу Koizumi, как технически менее сложная модель фокальной ишемии, соответствующая ишемическому инсульту, вызванному окклюзией церебрального сосуда с последующей реперфузией.
Определяющим параметром, от которого зависит тяжесть ишемического повреждения ГМ является продолжительность ОСМА. В разных исследованиях она составляет от 1 до 3 часов для интактных животных разных линий [5,7] и от 20 до 90 минут для животных с различными нарушениями углеводного обмена (модели алиментарного ожирения, стрептозотоцин индуцированного СД 1 и 2 типа, и генетические модели) [8]. В отечественных лабораториях для исследования церебропротекторных свойств новых соединений наиболее часто используются крысы линии Wistar, а в качестве модели экспериментального СД 2 типа – различные формы стрептозотоцин индуцированного СД (стрептозотоцин-никотинамид-индуцированный СД, аллоксановый СД, развивающийся СД, введение низких доз стрептозотоцина на фоне высокожировой диеты).
В качестве модели сахарного диабета был выбран стрептозотоцин-никотинамид-индуцированный СД, который вызывали путем однократного внутрибрюшинного введения стрептозотоцина (65 мг/кг, Sigma-Aldrich, США) через 15 минут после предварительного введения никотинамида (230 мг/кг). Такая комбинация позволяет воспроизводить состояние в значительной степени близкое к СД 2 типа, проявляющееся в умеренной и стабильной гипергликемии, нарушении толерантности к глюкозе и появлении глюкозурии. Данная модель близка к патологическому состоянию, которое характеризуется частичной потерей бета-клеточной массы и может соответствовать одной из форм СД 2 типа [4,6].
В исследовании использовались 2 серии животных: интактные и крысы со стрептозотоцин-никотинамид-индуцированным СД продолжительностью 4 недели. В каждой серии было создано 3 группы: ложнооперированные животные, контрольные животные и крысы, которые после ОСМА получали церебропротектор цитиколин (500 мг/кг) [3]. Каждая группа разделялась на 2 части (n=10), одной моделировали ОСМА в течение 30 минут, другой в течение 60 минут (таблица). На протяжение 48 часов в фиксировалась гибель животных,а через 48 часов у выживших оценивался неврологический дефицит (шкала Garcia).
Статистическую обработку результатов исследования проводили с использованием Prism 5 икритериев Краскела-Уолиса, Манна-Уитни. Значимой считалась разница при p <0,05.
Результаты исследования и их обсуждение
По результатам эксперимента было отмечено, что ОСМА продолжительностью 60 минут у животных со стрептозотоцин-никотинамид-индуцированным СД вызывает значительно большее ишемическое повреждение ГМ, чем у здоровых. В группе интактных крыс с ОСМА наблюдалась единичная гибель, при этом в группах животных с диабетом и ОСМА в течение 48 часов погибло 80 % животных, не получавших лечение и 50 % в группе, получавшей цитиколин (таблица 1). При снижении продолжительности ОСМА до 30 минут в группе здоровых крыс с ОСМА отсутствовали видимые признаки неврологического дефицита. При этом в группе животных со стрептозотоцин-никотинамид-индуцированным СД без лечения количество погибших снизилось до 30 %, а в группе, получавшей цитиколин до 10 %.
Для оценки тяжести течения фокальной ишемии широко используется исследование неврологического дефицита по шкалеGarcia. В группах интактных животных с 30-минутной ОСМА средний неврологический дефицит не отличался между группами (критерий Краскела-Уолиса), а в группах животных с СД с 60–ти минутной ОСМА наблюдалась значительная гибель и корректно оценить неврологический дефицит не представлялось возможным. Поэтому целесообразно было оценить неврологический дефицит в группах интактных животных с 60-минутной ОСМА и в группах животных с СД с 30-минутной окклюзией (рисунок).
Смертность после ОСМА продолжительностью 30 и 60 минут у интактных животных и крыс со стрептозотоцин-никотинамид-индуцированным СД (n=10)
|
Группа |
Время ОСМА, мин |
Количество погибших животных после ОСМА |
Сумма |
% |
|||
|
6 часов |
12 часов |
24 часа |
48 часов |
||||
|
Интактные крысы-самцы |
|||||||
|
ЛО+физ.р-р |
30 |
- |
- |
- |
- |
- |
- |
|
60 |
- |
- |
- |
- |
- |
- |
|
|
ОСМА+физ.р-р |
30 |
- |
- |
- |
- |
- |
- |
|
60 |
- |
1 |
- |
- |
1 |
10 % |
|
|
ОСМА+Цитиколин* |
30 |
- |
- |
- |
- |
- |
- |
|
60 |
- |
- |
- |
- |
- |
- |
|
|
Крысы со стрептозотоцин-никотинамид-индуцированным СД продолжительностью 4 недели |
|||||||
|
СД+ЛО +физ.р-р |
30 |
- |
- |
- |
- |
- |
- |
|
60 |
- |
- |
- |
- |
- |
||
|
СД+ОСМА+физ.р-р |
30 |
- |
1 |
1 |
1 |
3 |
30 % |
|
60 |
3 |
3 |
2 |
- |
8 |
80 % |
|
|
СД+ОСМА +Цитиколин |
30 |
1 |
1 |
10 % |
|||
|
60 |
1 |
2 |
1 |
1 |
5 |
50 % |
|
Примечания: 1. «ЛО+физ.р-р» – ложно-оперированные интактные животные; «ОСМА+ физ.р-р» – группа с окклюзией средней мозговой артерии (ОСМА) без лечения; «СД+ЛО+физ.р-р» – ложно-оперированные животные со стрептозотоцин-никотинамид-индуцированным СД; «СД+ ОСМА+физ.р-р» – группа с ОСМА на фоне стрептозотоцин-никотинамид-индуцированного СД без лечения; n – количество животных в группе; % – относительное количество погибших животных в группе в процентах.
2. *Цитиколин вводили через 1 час после моделирования ОСМА и далее 1 раз в сутки.
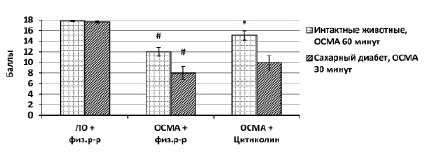
# – различия достоверны относительно соответствующей группы «ЛО+физ.р-р»; * – различия достоверны относительносоответствующей группы «ОСМА+физ.р-р» (p<0,05)
При оценке неврологического дефицита по шкале Garcia было отмечено, что в группах животных с СД и 30 минутной ОСМА наблюдался выраженный неврологический дефицит, который оставался на высоком уровне в группе, получавшей цитиколин. Это очевидно связанно с высокой чувствительностью животных с СД к ишемическому поражению ГМ при отсутствии гипогликемической терапии. В группах интактных животных и 60-минутной ОСМА наблюдался менее выраженный неврологический дефицит по шкале Garcia, который был значимо ниже в группе, получавшей цитиколин.
Полученный результат свидетельствует о значительном снижении устойчивости животных со стрептозотоцин-никотинамид-индуцированным СД к ишемическому повреждению ГМ, что может быть следствием эндотелиальной дисфункции, прокоагулянтного состояния системы гемостаза и метаболических нарушений в организме животных [2]. При этом снижение продолжительности ОСМА на фоне СД до 30 минут приводило к снижению количества погибших животных при сохранении неврологического дефицита на высоком уровне. Описанные модели могут быть использованы для поиска церебропротекторов, предполагаемых к применению на фоне СД, либо оценки церебропротекторного потенциала у гипогликемических препаратов.
Вывод
Для оценки церебропротекторной активности исследуемого соединения, предполагаемого к применению при ишемии головного мозга на фоне сахарного диабета, целесообразно использование модели 30-минутной окклюзии средней мозговой артерии у животных со стрептозотоцин-никотинамид-индуцированным сахарным диабетом.
Библиографическая ссылка
Бакулин Д.А. ОККЛЮЗИЯ СРЕДНЕЙ МОЗГОВОЙ АРТЕРИИ У КРЫС ЛИНИИ WISTARС ЭКСПЕРИМЕНТАЛЬНЫМ САХАРНЫМ ДИАБЕТОМ: ВЫБОР ОПТИМАЛЬНОЙ ПРОДОЛЖИТЕЛЬНОСТИ ИШЕМИИ // Международный журнал прикладных и фундаментальных исследований. – 2016. – № 11-6. – С. 1040-1043;URL: https://applied-research.ru/ru/article/view?id=10718 (дата обращения: 20.04.2024).

