Методы селекции направлены на улучшение старых и создание новых сортов культурных растений с более ярко выраженными хозяйственно ценными признаками, такими как высокая урожайность, устойчивость к биотическим и абиотическим стрессам. В этом направлении биотехнология, и в частности генная инженерия, становится «помощником» традиционной селекции, так как позволяет вводить в геном растения чужеродные гены, отвечающие за полезные качества. При использовании методов биоинженерии необходимо проводить исследования морфогенного потенциала и регенерационной способности для каждого нового целевого генотипа растения.
Рапс озимый (Brassica napus) принадлежит к семейству Brassicaceae и является ценным растением, возделываемым для получения масла пищевого или технического назначения.
Растения данного семейства являются довольно хорошо изученными для применения методов биотехнологии. Работы по введению Brassica napus в культуру in vitro начались приблизительно с 70-х годов прошлого века. За это время были изучены различные факторы, влияющие на каллусогенез и регенерацию растений in vitro, такие как возраст, размер и тип экспланта, генотип растения, состав питательной среды, эффект различных экзогенных регуляторов роста [1–5], однако все эти исследования велись с использованием сортов рапса ярового типа [6, 7]. Относительно озимого рапса имеются лишь единичные сообщения [8–10]. Известно, что регенерация растений сильно зависит от специфичности генотипа [11], поэтому необходимо разработать надежный и воспроизводимый протокол регенерации для определенного генотипа или сорта. Целью данной работы являлось изучение морфогенного потенциала и регенерационной способности озимого рапса отечественной селекции, который является перспективным объектом для дальнейшей трансформации и селекции [11, 12].
Материалы и методы исследования
Растительный материал. В качестве объекта исследований был использован сорт озимого рапса (Brassica napus) Северянин отечественной селекции (ФГБНУ «ВНИИ кормов им. В.Р. Вильямса»). Сорт двунулевой, допущен к возделыванию в Центральном и Центрально-Черноземном регионах. В масле практически отсутствует эруковая кислота и глюкозинолаты. Коммерческая ценность данного сорта состоит в высокой семенной и кормовой продуктивности, качестве масла и шрота, устойчивости к основным болезням, технологичности возделывания и уборки, высокой зимостойкости относительно других сортов озимого рапса отечественной селекции.
Питательные среды. Для проращивания семян в стерильных условиях использовали агаризованную среду Мурасиге – Скуга (MS), содержащую половинную концентрацию макросолей. Для изучения регенерационной способности растений озимого рапса использовали среду MS с добавлением микроэлементов, витаминов и регуляторов роста в различных концентрациях и комбинациях в шести вариантах, подобранных согласно данным литературных источников.
Получение донорных растений в асептических условиях. Для получения растительного материала использовали стерильные донорные растения, полученные в асептических условиях. Для этого первоначально отбирали наиболее крупные семена рапса, затем их стерилизовали в водном растворе коммерческого препарата «Белизна» различной концентрации (от 15 до 50 %) и временной экспозиции (от 10 до 35 минут). После этого семена пятикратно промывали дистиллированной водой. Семена в количестве 25 штук помещали в стерильные культуральные емкости, заполненные средой MS, не содержащей экзогенных регуляторов роста, и культивировали при температуре 23–25 °С, интенсивности освещения 65 mol m-2 s-1 и фотопериоде 16/8 часов (день/ночь) в световом модуле Лаборатории генной инженерии растений ВНИИСБ.
Подготовка эксплантов и их культивирование. При достижении донорными растениями 12–14-дневного возраста их подвергали сегментированию в асептических условиях. В экспериментах по регенерации в качестве эксплантов использовали сегменты длиной около 7 мм из верхней, средней и нижней частей гипокотиля, которые помещали на чашки Петри диаметром 90 мм, заполненные 20–25 мл агаризованной питательной среды MS с добавлением регуляторов роста в различных комбинациях. На одну чашку Петри располагали 15 штук эксплантов, эксперименты проводили в трехкратной повторности для каждого варианта.
Каллусогенез и регенерация. В экспериментах по индукции каллусогенеза использовали 6 вариантов состава питательных сред, различающихся по содержанию фитогормонов и регуляторов роста.
Для роста образовавшихся побегов использовали среду MS, содержащую регуляторы роста в пониженных концентрациях. Каждые 3 недели экспланты пассировали на свежие среды.
В экспериментах были использованы следующие концентрации и комбинации регуляторов роста:
1. 1 мг/л 2,4-Д (первый пассаж), далее 4 мг/л 6-БАП + 2 мг/л Зеатин.
2. 1 мг/л 2,4-Д + 1 мг/л 6-БАП (первый пассаж), далее 1 мг/л 6-БАП.
3. 0,1 мг/л НУК + 1 мг/л 6-БАП (первый пассаж), далее 0,1 мг/л НУК + 1 мг/л 6-БАП.
4. 0,1 мг/л НУК + 2 мг/л 6-БАП (первый пассаж), далее 0,1 мг/л НУК + 2 мг/л 6-БАП.
5. 0,05 мг/л НУК + 0,3 мг/л ТДЗ (первый пассаж), далее 0,3 мг/л ТДЗ + 0,1 мг/л НУК.
6. 0,05 мг/л НУК + 0,1 мг/л ТДЗ (первый пассаж), далее 0,1 мг/л ТДЗ + 0,1 мг/л НУК.
В ходе эксперимента учитывали три показателя эффективности влияния регуляторов роста на процессы морфогенеза у эксплантов:
1. Эффективность каллусогенеза (выражали в процентах путем деления количества эксплантов, образовавших каллус, на общее количество эксплантов в каждом варианте).
2. Интенсивность пролиферации эксплантов (выражали кратностью увеличения объема экспланта путем деления начального объема сегмента гипокотиля на объем образовавшегося каллуса в каждом варианте).
3. Эффективность регенерации из эксплантов (выражали в процентах путем деления количества эксплантов, образовавших побеги, на общее количество эксплантов в каждом варианте).
Статистическую обработку данных проводили с помощью дисперсионного анализа с последующим множественным сравнением частных средних и оценки их по критерию Дункана.
Результаты исследования и их обсуждение
Для получения донорных растений при последующей работе в условиях in vitro необходимо разработать методику эффективной стерилизации, обеспечивающую наибольший выход стерильного материала при наименьшей его гибели. Наибольший выход стерильного материала при наименьшей гибели растений был достигнут при выдерживании семян в 25 % водном растворе коммерческого препарата «Белизна» в течение 20 минут. При менее длительной экспозиции наблюдалось бактериальное и грибное заражение проростков. При более длительной экспозиции наблюдался значительный процент гибели растительного материала.
Известно, что тип экспланта и экзогенные регуляторы роста оказывают большое воздействие на частоту регенерации при использовании различных методов культивирования тканей. Для исследования морфогенного потенциала генотипа и разработки системы эффективной и стабильной регенерации целых растений было изучено влияние типа экспланта и комбинаций регуляторов роста на каллусогенез, пролиферацию и регенерацию растений. Комбинации регуляторов роста были подобраны согласно литературным источникам.
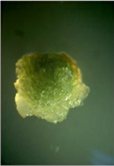
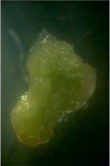

А Б В
Рис. 1. Каллусогенез у гипокотилей рапса при использовании различных регуляторов роста: А – НУК + 6-БАП (вар. 4), Б – НУК + ТДЗ (вар. 5), В – 2,4-Д (вар. 1)
Таблица 1
Влияние различных комбинаций регуляторов роста на каллусогенез, интенсивность пролиферации и эффективность регенерации озимого рапса
|
Сегмент гипокотиля |
Показатель |
Вариант состава среды |
Средние |
|||||
|
1 |
2 |
3 |
4 |
5 |
6 |
|||
|
Верхний |
Каллусогенез ( %) |
96 |
100 |
100 |
65 |
100 |
100 |
93,5 |
|
Интенсивность пролиферации (раз) |
92,67ab |
168,99ijk |
148,19ghi |
123,03cdefg |
167,84hijk |
112,07bcd |
133,78 |
|
|
Регенерация ( %) |
22,00abcd |
0 |
18,00abc |
0 |
32,00bcd |
7,00ab |
13,17 |
|
|
Средний |
Каллусогенез ( %) |
98 |
99 |
97 |
80 |
100 |
100 |
95,67 |
|
Интенсивность пролиферации (раз) |
104,09abc |
140,32ghi |
139,79fg |
143,36ghi |
146,30ghi |
102,56abc |
130,4 |
|
|
Регенерация ( %) |
40,00cd |
0 |
2,33a |
0 |
0 |
1,75a |
7,48 |
|
|
Нижний |
Каллусогенез ( %) |
100 |
99 |
97 |
80 |
99 |
100 |
95,83 |
|
Интенсивность пролиферации (раз) |
85,11a |
137,11efg |
132,79defg |
180,97k |
176,28jk |
110,60abcd |
131,81 |
|
|
Регенерация ( %) |
49,33d |
2,00a |
0 |
10,00ab |
0 |
0 |
10,22 |
|
|
Средние |
По каллусогенезу ( %) |
98 |
99,33 |
98 |
75 |
99,67 |
100 |
|
|
По интенсивности пролиферации (раз) |
94,37a |
148,13c |
139,67bc |
149,12c |
156,56c |
104,11a |
||
|
По регенерации ( %) |
37,43b |
2,71a |
11,30a |
6,15a |
11,48a |
7,65a |
||
Примечание. (a-k) – достоверно различающиеся кластеры данных согласно оценке множественных средних по критерию Дункана.
Для двудольных растений и, в частности, семейства Brassicaceae наиболее эффективным регулятором роста для образования каллуса являются цитокинины, преимущественное использование имеет бензиладенин. Регулятор роста тидиазурон (замещенная фенилмочевина (N-фенил N’-1,2,3-тиадиазол-5-илмочевина) не относится к цитокининам, но по характеру воздействия на процессы каллусообразования схож с таковыми. Такой регулятор роста, как 2,4-Д, относится к ауксиновому типу и используется для инициации каллусогенеза у однодольных растений, однако есть сведения, что он может быть в некоторых случаях применен и для двудольных растений [1].
Для инициации каллусообразования в наших исследованиях были использованы цитокинины (бензиладенин 6-БАП), ауксины [2,4-Д, альфа-нафтилуксусная кислота (НУК)], а также тидиазурон (ТДЗ).
Эффективность каллусогенеза составляла порядка 100 % во всех вариантах проведенных нами опытов. Наиболее высокая пролиферативная активность, согласно анализу частных средних, была отмечена на среде, содержащей 0,1 мг/л НУК в сочетании с 1 мг/л 6-БАП (рис. 1, А), а по общим – в варианте сочетания ТДЗ и НУК в концентрациях 0,3 мг/л и 0,1 мг/л (рис. 1, Б, табл. 1).
Использование 1 мг/л 2,4-Д в первом пассаже с последующей пересадкой на среду, содержащую 4 мг/л 6-БАП + 2 мг/л зеатина, обеспечило наиболее высокий процент регенерации побегов (49,3 %) при использовании эксплантов из нижней части гипокотиля (рис. 2, В). Несколько меньшая регенерационная способность наблюдалась в варианте с использованием верхней части гипокотиля при добавлении ТДЗ в концентрации 0,3 мг/л (табл. 1). Однако, согласно литературным данным, использование ТДЗ значительно повышает регенерационную способность эксплантов, в связи с этим было осуществлено более детальное изучение влияния различных концентраций ТДЗ (в сочетании с 0,1 мг/л НУК) на регенерацию рапса (табл. 2). В данном исследовании использовали среднюю часть гипокотиля.



А Б В
Рис. 2. Образование побегов рапса из каллусов при использовании различных регуляторов роста: А – НУК + 6-БАП (вар. 4), Б – НУК + ТДЗ (вар. 3), В – 2,4-Д (вар. 1)
Таблица 2
Влияние различных концентраций тидиазурона на регенерацию озимого рапса
|
Концентрация ТДЗ, мг/л |
Эффективность регенерации, % |
|
0,15 |
33,9bc |
|
0,3 |
81,8d |
|
0,45 |
63,9cd |
|
0,6 |
23,2ab |
|
0,75 |
3,3a |
Примечание. (a-d) – достоверно различающиеся кластеры данных согласно оценке множественных средних по критерию Дункана.
Анализ данных, приведенных в табл. 2, свидетельствует о том, что наиболее высокую регенерационную способность (81,8 %) продемонстрировали экспланты, культивируемые на среде с добавлением 0,3 мг/л ТДЗ и 0,1 мг/л НУК. Регенерация растений в данном варианте практически в 2 раза превысила таковую при использовании первого варианта.
Заключение
Анализ морфогенетического потенциала озимого рапса сорта Северянин показал, что эффективность каллусогенеза при использовании эксплантов, полученных от гипокотилей 14-дневных проростков в культуре in vitro, составляет от 65 до 100 % на всех экспериментальных средах, изученных в процессе исследования. Наибольшая интенсивность пролиферации каллусной культуры отмечена при культивировании эксплантов из нижней части гипокотиля на среде с добавлением 0,1 мг/л НУК + 2 мг/л 6-БАП, однако определяющим фактором морфогенетического потенциала является эффективность регенерации побегов, а она в этом варианте была низкой (10 %). При культивировании эксплантов на инициирующей среде, содержащей 1 мг/л 2,4-Д, с последующим пассажем на среду с добавлением 4 мг/л 6-БАП + 2 мг/л зеатина эффективность регенерации побегов была максимальной и в варианте с использованием нижней части гипокотиля составила 49,3 %. Наиболее высокая эффективность регенерации отмечена при культивировании эксплантов на среде с добавлением 0,1 мг/л НУК и 0,3 мг/л ТДЗ (81,8 %).
Исследования проведены в рамках выполнения ГЗ (0574-2014-0024) № госрегистрации АААА-А17-117082950004-9.
Библиографическая ссылка
Чернобровкина М.А., Хватков П.А., Леонтьева А.В., Долгов С.В. ИЗУЧЕНИЕ МОРФОГЕНЕТИЧЕСКОГО ПОТЕНЦИАЛА ОЗИМОГО РАПСА ОТЕЧЕСТВЕННОЙ СЕЛЕКЦИИ В КУЛЬТУРЕ IN VITRO // Международный журнал прикладных и фундаментальных исследований. – 2017. – № 11-2. – С. 260-264;URL: https://applied-research.ru/ru/article/view?id=12010 (дата обращения: 18.04.2024).

