На фармацевтическом рынке г. Омска представлено большое количество препаратов ибупрофена в различных лекарственных формах и дозировках, что затрудняет выбор провизором конкретного препарата при фармацевтическом консультировании потребителей. При изучении доступных литературных источников нам не удалось обнаружить данных по сравнительному изучению кинетики растворения бренда и дженериков ибупрофена.
Ибупрофен относится к группе нестероидных противовоспалительных средств (НПВС) и применяется при болях различного генеза, в том числе довольно широко – в детской практике [1, 2]. Для НПВС скорость наступления эффекта и, следовательно, облегчения боли можно назвать одним из главных факторов, влияющих на выбор препарата конечными и промежуточными потребителями. Биодоступность препарата, то есть скорость, с которой активная субстанция всасывается из готовой лекарственной формы и поступает в кровоток, можно косвенно выявить с помощью теста «Растворение»: препарат, высвобождающий наибольшее количество действующего вещества в среду растворения в первые 5–10 минут проведения испытания, может считаться самым быстродействующим среди других изучаемых препаратов [3, 4].
В связи с вышесказанным целью работы является изучение кинетики растворения таблеток с ибупрофеном разных производителей для обоснованного консультирования пациентов врачами и фармацевтическими работниками.
Материалы и методы исследования
Объекты исследования. Для проведения испытания использовались таблетки с ибупрофеном по 200 мг, покрытые оболочкой:
- Нурофен «Рекитт Бенкизер Хелскэр Интернешнл Лтд», Великобритания;
- Ибупрофен ПАО «Биосинтез», Россия;
- Ибупрофен ОАО «Синтез», Россия;
- Ибупрофен «Борисовский завод медицинских препаратов» («БЗМП»), Беларусь.
Препараты были приобретены в розничной аптечной сети г. Омска.
Реактивы. Натрия гидрофосфат (х.ч., ГОСТ 4172-76, ООО «Омскреактив»); кислота лимонная (х.ч., ГОСТ 3652-69, ООО «Омскреактив»); феррицианид калия (х.ч., ГОСТ 4206-75, ООО «Омскреактив»); спирт этиловый 96 % (ОГУП «Омская фармацевтическая фабрика»); вода очищенная, соответствующая требованиям ФС.2.2.0020.15 «Вода очищенная».
Приборы и оборудование. Исследование кинетики растворения таблеток проводили на Приборе для испытания таблеток и капсул на растворение (ООО НПК «Текномеда»). Прибор состоит из стеклянного сосуда вместимостью 500 мл, лопастной мешалки и водяной бани для поддержания температуры среды растворения 37,0 ± 0,5 °С.
Навески брали на аналитических весах OHAUS (ООО «Старт») с точностью 0,0002 г.
Для осуществления микроскопических исследований использовали микроскоп стереоскопический Микромед МС-1 (ООО «Оптические приборы»).
Количественное определение высвободившегося из таблеток ибупрофена проводили по методике И.П. Сыроватского с соавторами [5]. Анализ проб на содержание действующего вещества проводили на спектрофотометре СФ-2000 (Россия) в интервале длин волн от 220 до 300 нм в кварцевых кюветах с толщиной слоя 1 см.
Методика проведения испытания по тесту «Растворение»
Приготовление фосфатного буферного раствора pH 6,8 осуществляли согласно ОФС.1.3.0003.15 «Буферные растворы».
Тест «Растворение» проводили в соответствии с ОФС.1.4.2.0014.15 «Растворение для твердых дозированных лекарственных форм». Сосуд аппарата для растворения наполняли 1 л фосфатного буферного раствора с pH 6,8, доводили температуру среды растворения до 37 ± 0,5 °С. Таблетку испытуемого препарата помещали в сосуд, включали вращение (100 об/мин). Пробы отбирались каждые 5 минут после начала эксперимента (через 5, 10, 15, 20, 25, 30, 35, 40, 45 минут) на ½ расстояния между поверхностью среды растворения и верхней частью лопасти мешалки и на расстоянии не менее 1 см от стенок сосуда для растворения.
Количественное определение ибупрофена методом спектрофотометрии
Измерение проводили при длине волны 259 ± 2 нм. В качестве раствора сравнения использовали фосфатный буферный раствор pH 6,8.
Расчет количества ибупрофена рассчитывали по формуле
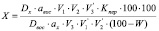 ,
,
где Dx и Dвос – оптические плотности определяемого вещества и образца сравнения соответственно;
ax и aвос – точные навески определяемого вещества и образца сравнения соответственно, г;
V1, V2 – объемы приготовленного раствора определяемого вещества, мл;
V3 – объем аликвоты определяемого вещества, мл;
V'1, V'2 – объемы приготовленного раствора образца сравнения, мл;
V'3 – объем аликвоты образца сравнения, мл;
100 – коэффициент для пересчета в проценты;
W – влажность, %;
Кпер – коэффициент пересчета по феррицианиду калия (в 0,1 М растворе гидроксида натрия равен 2,279).
Получение микрокристаллоскопических изображений изучаемых препаратов
Около 0,05 г измельчённой в ступке таблеточной массы помещали в пробирку, прибавляли 5 мл спирта этилового, встряхивали в течение 2 мин, фильтровали через бумажный фильтр. Каплю фильтрата помещали на предметное стекло, после полного высыхания рассматривали под микроскопом.
Обработка полученной информации проведена с помощью пакета лицензионных программ по статистической обработке данных «Statistica».
Результаты исследования и их обсуждение
Состав объектов исследования представлен в таблице.
Таблица 1
Состав исследуемых препаратов ибупрофена
|
Образец |
Действующее вещество |
Вспомогательные вещества |
|
Нурофен |
Ибупрофен 200 мг |
Акации камедь, кармеллоза натрия, кислота стеариновая, кремния диоксид коллоидный, кроскармеллоза натрия, макрогол 6000, натрия лаурилсульфат, натрия цитрата дигидрат, сахароза, тальк, титана диоксид, чернила черные |
|
Ибупрофен «Биосинтез» |
Сахароза, титана диоксид, ванилин, воск, декстрин, желатин, кислотный красный 2C, крахмал картофельный, магния стеарат, мука пшеничная, повидон низкомолекулярный, сахарная пудра |
|
|
Ибупрофен «Синтез» |
Кремния диоксид коллоидный, сахароза, тальк, ванилин, воск, желатин, кислотный красный 2C, повидон низкомолекулярный, кальция стеарат, магния карбонат |
|
|
Ибупрофен «БЗМП» |
Тальк, титана диоксид, крахмал картофельный, магния стеарат, повидон низкомолекулярный, кальция стеарат, макрогол 3350, лецитин |
Примечание. Полужирным шрифтом выделены вещества, входящие в состав нескольких препаратов разных производителей.
В результате проведения испытаний были построены профили растворения изучаемых препаратов (рис. 1).
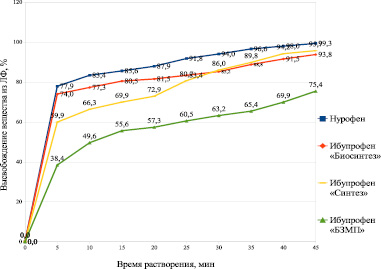
Рис. 1. Профили растворения испытуемых препаратов
Из полученных данных следует, что все препараты соответствуют требованиям Государственной фармакопеи (ГФ) по тесту «Растворение», поскольку через 45 минут в среду растворения высвободилось не менее 75 % ибупрофена. При этом уже через 5 минут из препаратов Нурофен и Ибупрофен ПАО «Биосинтез» высвободилось более 70 % действующего вещества, из чего можно сделать вывод, что пациент может ощутить эффект от приёма препарата уже через 5 минут.
Для сопоставления профилей растворения ВОЗ [6, 7] рекомендует рассчитывать коэффициент подобия f2, который оценивает подобие двух кривых профиля растворения в %. Коэффициент подобия рассчитывается по следующей формуле:
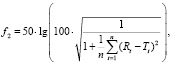
где n – число временных точек,
Rt – высвобождение препарата сравнения во временной точке t,
Tt – высвобождение из испытуемого препарата в точке t.
Считается, что значимые различия между кривыми профилей растворения отсутствуют, если коэффициент подобия принимает значения от 51 до 100.
В табл. 2 приведены рассчитанные коэффициенты подобия для профилей растворения изучаемых лекарственных средств.
Таблица 2
Коэффициенты подобия для профилей растворения испытуемых препаратов
|
Образец |
Нурофен |
Ибупрофен «Биосинтез» |
Ибупрофен «Синтез» |
Ибупрофен «БЗМП» |
|
Нурофен |
– |
58,6 |
45,6 |
25,2 |
|
Ибупрофен «Биосинтез» |
58,6 |
– |
55,7 |
30,2 |
|
Ибупрофен «Синтез» |
45,6 |
55,7 |
– |
34,6 |
|
Ибупрофен «БЗМП» |
25,2 |
30,2 |
34,6 |
– |
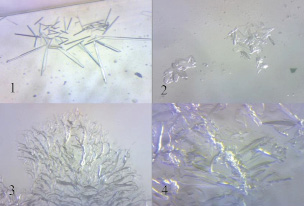
Рис. 2. Микрокристаллоскопические изображения изучаемых ЛП после растворения в спирте: 1 – Нурофен, 2 – Ибупрофен ПАО «Биосинтез», 3 – Ибупрофен ОАО «Синтез», 4 – Ибупрофен «БЗМП»
Проведенные расчёты показали, что значимых различий в кривых профилей растворения не выявлено для пар Нурофен и Ибупрофен ОАО «Биосинтез», Ибупрофен ОАО «Биосинтез» и Ибупрофен ПАО «Синтез», в связи с чем можно говорить о сходной кинетике высвобождения ибупрофена из данных препаратов. Для остальных препаратов различие в профилях растворения статистически значимо.
Различие в биодоступности лекарственных средств in vitro может быть связано со вспомогательными веществами, входящими в состав препаратов. Совместное влияние вспомогательных веществ было выявлено при микроскопическом исследовании объектов анализа.
Микрокристаллоскопические изображения всех четырёх лекарственных препаратов имеют значительные различия (рис. 2).
Оригинальный препарат (1) представлен острыми игольчатыми кристаллами, в образце 2 видны фрагментированные группы мелких кристаллов, а препараты 3 и 4 представляют собой аморфные образования. Полученные результаты коррелируют с литературными данными [8] о влиянии на кинетику растворения таблеток вспомогательных веществ из группы смазывающих.
Результаты изучения скорости растворения образцов и микроскопических исследований позволяют предположить, что таблетки со стеариновой кислотой (в данном случае Нурофен) высвобождают действующее вещество значительно быстрее, чем содержащие магния стеарат (Ибупрофен ПАО «Биосинтез») и/или кальция стеарат (Ибупрофен ОАО «Синтез», Ибупрофен ОАО «БЗМП»).
Заключение
1. Все выбранные объекты соответствуют требованиям ОФС.1.4.2.0014.15 «Растворение для твердых дозированных лекарственных форм». Через 45 минут из всех образцов в среду растворения перешло не менее 75 % ибупрофена. Наибольшая скорость высвобождения обнаружена у препарата «Нурофен»: уже через 5 минут в среде растворения определяется 77,9 % действующего вещества. Более 75 % ибупрофена высвобождается в среду растворения из препарата «Ибупрофен» (ПАО «Биосинтез») через 10 минут, из «Ибупрофен» (ОАО «Синтез») – через 20–25 минут, из «Ибупрофен» («Борисовский завод медицинских препаратов», «БЗМП») – через 45 минут.
2. При микроскопическом исследовании выбранных препаратов обнаружены значительные различия в строении кристаллов. Данное наблюдение требует дальнейших исследований для выявления влияния вспомогательных веществ на биодоступность ибупрофена из лекарственных средств.
3. Разработаны рекомендации для консультирования клиентов аптек и пациентов: обезболивающий и жаропонижающий эффекты при применении препаратов «Нурофен» и «Ибупрофен» (производства ПАО «Биосинтез») могут наступить уже через 5–10 минут после приёма, в связи с чем их выбор предпочтителен в детской практике или в случае, если критически важно скорейшее избавление от боли. При отпуске из аптеки препаратов «Ибупрофен» (ОАО «Синтез») и «Ибупрофен» («БЗМП») следует предупреждать пациента, что фармакологический эффект наступит через 20–40 минут.
Библиографическая ссылка
Подгурская В.В., Савченко И.А., Корнеева И.Н., Лукша Е.А., Попова А.П. ИССЛЕДОВАНИЕ БИОДОСТУПНОСТИ IN VITRO ТАБЛЕТОК С ИБУПРОФЕНОМ // Международный журнал прикладных и фундаментальных исследований. – 2018. – № 6. – С. 85-89;URL: https://applied-research.ru/ru/article/view?id=12297 (дата обращения: 20.04.2024).

