Ток, активируемый гиперполяризацией (If), или «funny» ток, протекающий по чувствительным к циклическим нуклеотидам катионным каналам (hyperpolarization – activated cyclic nucleotide gated channels) HCN, участвует в формировании фазы медленной диастолической деполяризации (пейсмекерный потенциал, фаза 4) у клеток водителя ритма синоаурикулярной (СА) области сердца взрослых млекопитающих [1, 2]. Мутации в генах, кодирующих HCN-каналы, вызывают брадикардию, но не приводят к подавлению спонтанной электрической активности в СА области [3, 4]. Однако функциональный вклад HCN-каналов в генерирование электрических импульсов в эмбриональном сердце остается неясным. Представления о роли ионных токов в миокарде эмбрионов сложились на основе работ, выполненных на изолированных клетках желудочков куриных эмбрионов [5; 6] и культурах эмбриональных стволовых клетках млекопитающих [7]. Использование различных объектов и методик стало причиной значительного расхождения в экспериментальных данных [6]. Так, ряд авторов придерживаются мнения, что ток If играет ведущую роль в автоматизме в эмбриональном сердце [8], другие считают, что в основе спонтанных сокращений лежат входящие Ca2+–токи [9] или «Ca2+–часы» [10]. В связи с этим существует необходимость в проведении исследований на ткани правого предсердия эмбрионального миокарда – зоны, в которой возникает электрическая активность. Использование многоклеточных препаратов позволяет сохранить электрическое взаимодействие между клетками, приблизить условия эксперимента к естественным, что обеспечит более полное понимание механизмов возникновения электрических импульсов в эмбриональном миокарде [11].
Цель исследования: с помощью ингибированного анализа и микроэлектродной техники оценить функциональный вклад HCN-каналов в формирование электрической активности клеток водителя ритма правого предсердия у эмбрионов курицы и мыши. В качестве ингибиторов HCN-каналов использовали ионы цезия и ивабрадин. Однако применение Cs+ имеет некоторые ограничения ввиду его способности блокировать выходящие К+–токи. Ивабрадин широко применяется в клинической практике, но его эффект может зависеть от величины максимального диастолического потенциала и частоты генерации ПД [12]. Поэтому для получения более точных результатов мы использовали оба блокатора.
Материалы и методы исследования
Эксперименты проводили на эмбрионах курицы и мыши в возрасте 12–14 суток. Экспериментальный протокол соответствовал международными правилам «Для использования лабораторных животных» (Guide for the Care and Use of Laboratory Animals, 8-е издание, опубликованное National Academies Press (US) 2011 г.). Сердце извлекали и помещали в раствор Тироде следующего состава (мМ/л): 140 NaCl; 10 NaHCO3; 5,4 KCl; 1,8 CaCl2; 1 MgSO4; 0,33 Na2HPO4, 10 глюкоза; 5 HЕРЕS (pH 7,4); удаляли желудочки и левое предсердие, правое предсердие вскрывали. Спонтанно сокращающийся препарат, размер которого не превышал 1×1 мм, помещали в проточную, аэрируемую, термостатируемую камеру с раствором Тироде (31 °C). Потенциалы действия регистрировали с помощью стандартной микроэлектродной техники со стороны субэндокарда. В качестве ингибиторов тока If использовали ионы цезия (2мМ) и ивабрадин (3 мкМ). Обработка результатов проводилась в программе PowerGraph Professional версия 3.3 (DIsoft, Россия) и с помощью оригинальных программ вычисления параметров потенциалов в программной среде Delphy, разработанных с.н.с., д.б.н. Н.В. Артеевой. Данные приведены как среднее арифметическое ± стандартное отклонение (М ± σ). Значимость различий определяли по U-критерию Манна – Уитни. Различия считали достоверными при р < 0,05.
Результаты исследования и их обсуждение
На сопоставимых сроках эмбрионального развития в контрольном растворе Тироде (31 °C) у клеток правого предсердия эмбрионов курицы и мыши зарегистрированы потенциалы действия (ПД) с фазой медленной диастолической деполяризации (МДД). Анализ основных параметров потенциалов действия выявил, что клетки данного типа у эмбрионов курицы и мыши отличаются по ряду электрофизиологических характеристик (табл. 1, рис. 1). Частота генерации спонтанных импульсов составила 135 ± 16 и 173 ± 22 имп/мин у препаратов правого предсердия мыши и курицы соответственно. Это различие обусловлено более продолжительной фазой МДД у клеток водителя ритма мыши по сравнению с куриными эмбрионами.
Таблица 1
Электрофизиологические параметры потенциалов действия клеток правого предсердия эмбрионов мыши и курицы
|
Параметры ПД |
Эмбрион мыши |
Эмбрион курицы |
|
n=10 |
n=15 |
|
|
Емах, мВ |
–63±9 |
– 74±8* |
|
АПД, мВ |
80±11 |
98±10** |
|
ПП, мВ |
– 51±9 |
– 66±9 |
|
ДПД20, мс |
38±10 |
42±19 |
|
ДПД100, мс |
131±54 |
122±24 |
|
МДД, мс |
319±62 |
231±45** |
|
ЧСС, имп/мин |
135±16 |
173±22** |
|
dV/dtmax, В/с |
44±16 |
109±36** |
|
V4, мВ/с |
39±16 |
37±17 |
|
V3, В/с |
–1,5±0,5 |
–2,3±0,6* |
Примечание. Emax – максимальный диастолический потенциал; АПД – амплитуда ПД; ПП – потенциал порога; ДПД20 и ДПД100 – длительность потенциала действия на уровне 20 и 100 % реполяризации; ЧСС – частота генерации ПД; МДД – длительность медленной диастолической деполяризации; dV/dtmax – скорость фазы быстрой деполяризации; V3 – скорость фазы конечной реполяризации; V4 – скорость фазы медленной диастолической деполяризации. n – количество препаратов. * р < 0,05 и ** р < 0,01 – достоверность различий по сравнению с эмбрионами мыши.
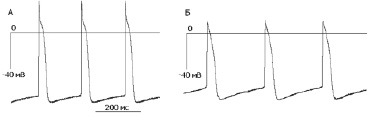
Рис. 1. Конфигурация потенциалов действия в контрольном растворе Тироде клеток водителя ритма правого предсердия у эмбрионов курицы (А) и мыши (Б) на 12–14 сутках эмбрионального развития
Эффекты ионов цезия и ивабрадина на генерацию ПД у эмбрионов мыши
При аппликации Cs+ (2 мМ, n = 4) в перфузирующий раствор зарегистрировано удлинение МДД на 45 %, что приводило к замедлению ЧСС на 26 %. У 75 % препаратов наблюдалось замедление скорости фазы МДД (V4) на 40 % (табл. 2; рис. 2, А). В 25 % случаях экспозиция цезия инициировала аритмию (рис. 2, Б). Эффекты ивабрадина (3 мкМ, n = 4) были сопоставимы с эффектами ионов цезия. Аппликация ивабрадина вызывала снижение частоты генерации ПД на 31 % за счет увеличения длительности МДД на 50 % (табл. 2; рис. 2, Б). Остальные параметры ПД достоверно не изменялись.
Таблица 2
Эффекты ионов цезия и ивабрадина на параметры ПД клеток правого предсердия у эмбрионов мыши
|
Параметры ПД |
Контроль n = 4 |
Cs+ 2 мМ n = 4 |
Контроль n = 4 |
Ивабрадин 3 мкМ n = 4 |
|
Емах, мВ |
–77 ± 13 |
–74 ± 19 |
–70 ± 13 |
–66 ± 8 |
|
АПД, мВ |
91 ± 19 |
89 ± 22 |
88 ± 18 |
88 ± 16 |
|
ДПД100, мс |
156 ± 49 |
166 ± 56 |
123 ± 4 |
141 ± 27 |
|
МДД, мс |
474 ± 174 |
682 ± 226* |
593 ± 111 |
875 ± 51* |
|
ЧСС, имп/мин |
102 ± 27 |
75 ± 20* |
85 ± 13 |
59 ± 3* |
|
dV/dtmax, В/с |
71 ± 59 |
72 ± 60 |
56 ± 20 |
43 ± 17 |
|
V4, мВ/с |
25 ± 17 |
16 ± 7 |
19 ± 8 |
17 ± 8 |
Примечание. * р < 0,05 – достоверность различий по сравнению с соответствующим контролем.
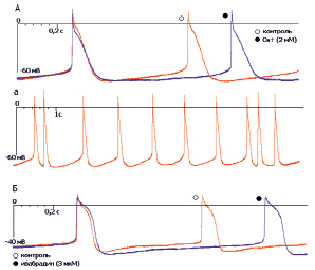
Рис. 2. Изменение конфигурации ПД при ингибировании каналов тока If у клеток правого предсердия эмбриона мыши. А – эффекты ионов цезия (2 мМ); а – нарушения генерации ПД, зарегистрированные при добавлении Cs+; Б – эффекты ивабрадина (3 мкМ)
Эффекты ионов цезия и ивабрадина на генерацию ПД у куриных эмбрионов
У клеток правого предсердия куриного эмбриона экспозиция Cs+ (2 мМ, n = 6) приводила к увеличению частоты генерации ПД на 15 % за счет укорочения фазы МДД на 25 %. При экспозиции ивабрадина (3 мкМ, n = 5) достоверных изменений в конфигурации электрофизиологических параметров ПД у данного типа клеток не зарегистрировано (табл. 3, рис. 3).
Таблица 3
Эффекты ионов цезия и ивабрадина на параметры ПД клеток правого предсердия куриного эмбриона
|
Параметры ПД |
контроль n = 6 |
Cs+ 2 мМ n = 6 |
контроль n = 5 |
Ивабрадин 3 мкМ n = 5 |
|
Емах, мВ |
–81 ± 7 |
–77 ± 8 |
–77 ± 7 |
–78 ± 9 |
|
АПД, мВ |
109 ± 6 |
96 ± 13 |
105 ± 12 |
101 ± 11 |
|
ДПД100, мс |
137 ± 26 |
133 ± 28 |
102 ± 21 |
110 ± 19 |
|
МДД,мс |
265 ± 17 |
215 ± 28* |
305 ± 65 |
316 ± 53 |
|
ЧСС, имп/мин |
150 ± 7 |
173 ± 11* |
150 ± 18 |
142 ± 16 |
|
dV/dtmax, В/с |
110 ± 15 |
80 ± 24 |
97 ± 19 |
92 ± 18 |
|
V4, мВ/с |
36 ± 28 |
42 ± 29 |
41 ± 10 |
41 ± 9 |
Примечание. * р < 0,05 – достоверность различий по сравнению с соответствующим контролем.
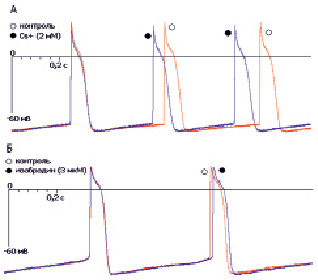
Рис. 3. Изменение конфигурации ПД при ингибировании каналов тока If у клеток правого предсердия куриного эмбриона. А – эффекты ионов цезия (2 мМ); Б – эффекты ивабрадина (3 мкМ)
Таким образом, в настоящей работе установлено, что на сопоставимых сроках эмбрионального развития (12–14 сутки) ингибирование HCN-каналов вызывает разные эффекты на генерацию электрических импульсов у эмбрионов курицы и мыши.
Экспозиция блокаторов HCN-каналов у клеток водителя ритма правого предсердия эмбрионов мыши приводила к замедлению частоты спонтанных сокращений в среднем на 30 %, что сопоставимо с ранее полученными данными на изолированных клетках желудочков эмбрионов [9, 10] и эмбриональных стволовых клетках мыши [7]. Аналогичный эффект зарегистрирован на изолированных препаратах синоаурикулярной области взрослых мышей: экспозиция цезия замедляла частоту генерации ПД на 35 % [13], а ивабрадина – на 24 % [14]. У новорожденных мышей различий в плотности тока If и в экспрессии HCN-каналов не обнаружено [15]. Все это позволяет заключить, что ток If, протекающий по HCN-каналам, возникает в момент появления первых электрических импульсов в сердце мыши (8,5 сутки) [9] и его вклад в автоматизм сохраняется в период эмбриогенеза, а также в постнатальном периоде. Это свидетельствует о важности тока If для формирования пейсмекерного потенциала в клетках СА узла мыши на всех этапах онтогенеза.
Полученные ранее результаты исследований клеточных механизмов автоматизма сердца куриных эмбрионов более неоднозначны. Известно, что ток If был зарегистрирован в изолированных клетках предсердия и желудочка сердца куриного эмбриона и диапазон его активации составил от –120 до –90 мВ. Однако такое значение максимального диастолического потенциала (Еmax) нетипично для клеток правого предсердия куриного эмбриона в нормальных физиологических условиях. Авторы заключили, что If лежит в основе спонтанной деполяризации, которая наблюдается в клетках желудочка в течение первой недели эмбрионального развития. Однако в клетках предсердия ток If не является существенным фактором, лежащим в основе спонтанной активности [5].
Наши данные, полученные на основе ингибиторного анализа, продемонстрировали, что у клеток правого предсердия куриного эмбриона ионы цезия и ивабрадин не вызывали достоверного отрицательного хронотропного эффекта на генерацию ПД. Можно предположить, что HCN-каналы не являются функционально активными на данном этапе онтогенеза и, следовательно, ток If не играет существенной роли в инициации электрических импульсов.
Заключение
Таким образом, клетки правого предсердия куриных и мышиных эмбрионов продемонстрировали разную чувствительность к блокаторам HCN-каналов. Вклад тока If у эмбрионов мыши в частоту генерирования электрических импульсов составляет ~30 %. У куриных эмбрионов на данном этапе эмбрионального развития ток If не является функционально важным и не участвует в формировании фазы пейсмекерного потенциала (фаза 4). Заключаем, что на данном этапе эмбриогенеза HCN-каналы в миокарде эмбрионов мыши играют более, а у куриных эмбрионов – менее важную роль в формировании медленной диастолической деполяризации и регуляции частоты спонтанных сокращений.
Работа поддержана грантом РФФИ мол_а № 18-34-00654.
Библиографическая ссылка
Лебедева Е.А., Гонотков М.А., Головко В.А. ОСОБЕННОСТИ ГЕНЕРИРОВАНИЯ ЭЛЕКТРИЧЕСКОЙ АКТИВНОСТИ ПРИ ИНГИБИРОВАНИИ HCN-КАНАЛОВ У КЛЕТОК ПРАВОГО ПРЕДСЕРДИЯ 13-ДНЕВНЫХ ЭМБРИОНОВ КУРИЦЫ И МЫШИ // Международный журнал прикладных и фундаментальных исследований. – 2019. – № 1. – С. 120-124;URL: https://applied-research.ru/ru/article/view?id=12652 (дата обращения: 19.04.2024).

