Азотсодержащие гетероциклы, особенно имеющие в своем составе халькогенсодержащий заместитель, представляют собой ценные во многих отношениях соединения. Обзор [1] посвящен синтезу и применению, а также исследованию спектроскопических свойств производных пиридина, содержащих один или два атома халькогена в разных положениях пиридинового кольца. Показана возможность применения этих соединений в координационной химии, органическом синтезе и биологии.
Многие природные производные пиридина проявляют биологическую активность, что привлекает внимание ученых к данному гетероциклу, а также к соединениям на его основе. Биологическая активность производных пиридина весьма разнообразна. Пиридиновое кольцо в качестве важной фармакофорной группы входит в структуру многих медицинских препаратов [2]. Ряд лекарственных средств имеет в своем составе пиридиновое кольцо, конденсированное с серосодержащим циклом (к примеру, пенициллин, цефалоспорин пироксикам, цефапирин и др.) [1, 3]. Подобные соединения, содержащие конденсированные пиридиновый и тиазольный циклы, обладают высокой противоопухолевой и антибактериальной активностью [4, 5].
В работах [6–8] сообщается о бактерицидных свойствах, противовоспалительной и анальгетической активности производных пиридина. Некоторые производные пиридина с серосодержащими функциональными группами проявляют различные типы биологической активности, в том числе анти-ВИЧ-активность [9].
Таким образом, синтез и исследование свойств новых водорастворимых гетероциклических соединений, содержащих в качестве фармакофорной группы пиридиновое кольцо, является актуальной задачей.
Цель исследования: разработка эффективных методов синтеза ранее неизвестных соединений с потенциальной биологической активностью, имеющих в своем составе фармакофорное пиридиновое кольцо, конденсированное с тиазольным циклом, на основе реакции пиридилсульфенилгалогенидов с гексеном-1 и гептеном-1.
Материалы и методы исследования
Дипиридинилдисульфид, гексен-1 и гептен-1 – импортные реактивы (Alfa Aesar).
Сульфурил хлорид и бром – импортные реактивы (Aldrich).
Спектры ЯМР сняты на приборе Bruker DPX-400 в CDCl3 на рабочих частотах 400,13 (1Н) и 100,61 (13С) в CDCl3. Внутренний стандарт: ГМДС. Элементный анализ выполнен на CHNS-анализаторе Thermo Scientific Flash 2000. Температуры плавления измерены на приборе Boёtius (PHMK 05 VEB Wagetechnik Rapido). В реакциях использовались осушенные и перегнанные растворители.
2-[(2-Хлорогексил)сульфанил]пиридин (1). К раствору 2,2’-дипиридинилдисульфида 0,090 г (0,40 ммоль) в 10 мл хлористого метилена добавляли раствор 0,055 (0,40 ммоль) сульфурил хлорида в 10 мл хлористого метилена. Через 5 минут добавляли по каплям раствор 0,067 г (0,80 ммоль) гексена-1 и перемешивали 16 ч при комнатной температуре. Растворитель удаляли на роторном испарителе, остаток сушили в вакууме. Выход 0,181 г (98 %), масло желтого цвета.
Спектр ЯМР 1Н (400,13 МГц, CDCl3), δ, м. д. (J, Гц): 00,63–0,67 м (3Н, CH3), 1,08–1,21 м (4Н, CH2), 1,54–1,63 м (1Н, CH2), 1,73–1,80 м (1Н, CH2), 3,57–3,62 м (1Н, SCH), 3,70–3,81 м (1Н, CH2Cl), 3,96 д.д (1Н, CH2Cl, J = 12,9, 4,3 Гц), 7,43–7,46 м (1Н, СPy), 7,82–7,84 м (1Н, СPy), 8,04–8,09 м (1Н, СPy), 8,42–8,46 м (1Н, СPy), Спектр ЯМР 13С (100,61 МГц, CDCl3), δ, м, д, (J, Гц): 13,19 (CH3), 21,49 (CH2), 28,93 (CH2), 32,78 (CH2), 48,29 (SCH), 64,42 (CH2Cl), 122,33 (Py), 122,67 (Py), 144,24 (Py), 146,28 (Py), 155,32 (NCS, Py). Найдено, %: С 57,95, Н 7,27, N 6,61. C11H16ClNS. Вычислено, %: С 57,50, Н 7,02, N 6,10.
2-Бутил-2Н,3Н-тиазоло[3,2-a]пиридин-4-ий хлорид (2). Соединение 1 растворили в хлороформе и нагревали на водяной бане в течение 1 ч. После охлаждения удаляли растворитель на роторном испарителе, сушили вакууме. Выход 0,180 г (98 %), масло желтого цвета.
Спектр ЯМР 1Н (400,13 МГц, CDCl3), δ, м. д. (J, Гц): 0,63–0,67 м (3Н, CH3), 1,08–1,21 м (4Н, CH2), 1,54–1,63 м (1Н, CH2), 1,73–1,80 м (1Н, CH2), 4,20–4,27 м (1Н, SCH), 5,06–5,11 м (1Н, CH2N), 5,48 д.д (1Н, CH2N, J = 13,7, 7,6 Гц), 7,48–7,51 м (1Н, СPy), 8,11–8,15 м (1Н, СPy), 8,39–8,41 м (1Н, СPy), 9,50–9,51 м (1Н, СPy). Спектр ЯМР 13С (100,61 МГц, CDCl3), δ, м. д. (J, Гц): 13,71 (CH3), 27,78 (CH2), 36,31 (CH2), 39,91 (CH2), 53,15 (SCH2), 60,59 (NCH), 122,67 (Py), 122,71 (Py), 140,52 (Py), 143,37 (Py), 158,71 (NCS, Py). Найдено, %: С 57,74, Н 7,20, N 6,35. C11H16ClNS. Вычислено, %: С 57,50, Н 7,02, N 6,10.
2-[(2-Хлорогептил)сульфанил]пиридин (3). К раствору 2,2’-дипиридинилдисульфида 0,107 г (0,48 ммоль) в 10 мл хлористого метилена добавляли раствор 0,066 (0,48 ммоль) сульфурил хлорида в 10 мл хлористого метилена. Через 5 минут добавляли по каплям раствор 0,096 г (0,97 ммоль) гептена-1 и перемешивали 16 ч при комнатной температуре. Растворитель удаляли на роторном испарителе, остаток сушили в вакууме. Выход 0,181 г (84 %), масло желтого цвета.
Спектр ЯМР 1Н (400,13 МГц, CDCl3), δ, м, д, (J, Гц): 0,70 с (3Н, CH3), 1,12–1,13 м (4Н, CH2), 1,38–1,39 м (2Н, CH2), 1,57–1,70 м (1Н, CH2), 1,80–1,89 м (1Н, CH2), 3,63–3,68 м (1Н, SCH), 3,85–3,90 м (1Н, CH2Cl), 4,02–4,06 м (1Н, CH2Cl), 7,49–7,52 м (1Н, СPy), 7,66–7,69 м (1Н, СPy), 8,09–8,11 м (1Н, СPy), 8,45–8,47 м (1Н, СPy), Спектр ЯМР 13С (100,61 МГц, CDCl3), δ, м. д. (J, Гц): 13,71 (CH3), 22,14 (CH2), 25,72 (CH2), 30,75 (CH2), 36,93 (CH2), 40,50 (SCH), 60,86 (CH2Cl), 122,21 (Py), 125,75 (Py), 141,52 (Py), 155,21 (Py), 155,77 (NCS, Py). Найдено, %: С 59,55, Н 7,69, N 5,91. C12H18ClNS. Вычислено, %: С 59,12, Н 7,44, N 5,75.
2-Пентил-2Н,3Н-тиазоло[3,2-a]пиридин-4-ий хлорид (4). Соединение 3 растворили в хлороформе и нагревали на водяной бане в течение 1 ч. После охлаждения удаляли растворитель на роторном испарителе, сушили вакууме. Выход 0,185 г (92 %), масло желтого цвета.
Спектр ЯМР 1Н (400,13 МГц, CDCl3), δ, м. д. (J, Гц): 0,70 с (3Н, CH3), 1,12–1,13 м (4Н, CH2), 1,28 с (2Н, CH2), 1,62–1,68 м (1Н, CH2), 1,80–1,87 м (1Н, CH2), 4,26–4,33 м (1Н, SCH), 5,14 д.д (1Н, CH2N, J = 14,1, 7,7 Гц), 5,56 д.д (1Н, CH2N, J = 13,6, 7,7 Гц), 7,55–7,58 м (1Н, СPy), 8,15–8,18 м (1Н, СPy), 8,48–8,49 м (1Н, СPy), 9,58–9,59 м (1Н, СPy). Спектр ЯМР 13С (100,61 МГц, CDCl3), δ, м. д. (J, Гц): 13,66 (CH3), 22,02 (CH2), 26,97 (CH2), 30,81 (CH2), 33,36 (CH2), 48,72 (SCH), 64,48 (NCH2), 122,75 (Py), 122,91 (Py), 143,81 (Py), 144,52 (Py), 158,97 (NCS, Py). Найдено, %: С 59.63, Н 7.71, N 5.92. C12H18ClNS. Вычислено, %: С 59,12, Н 7,44, N 5,75.
2-Бутил-2Н,3Н-тиазоло[3,2-a]пиридин-4-ий бромид (5). К раствору 2,2’-дипиридинилдисульфида 0,086 г (0,39 ммоль) в 10 мл хлористого метилена добавляли раствор 0,062 (0,39 ммоль) брома в 10 мл хлористого метилена. Через 5 минут добавляли по каплям раствор 0,065 г (0,78 ммоль) гексена-1 и перемешивали 20 ч при комнатной температуре. Растворитель удаляли на роторном испарителе, остаток сушили в вакууме. Выход 0,205 г (96 %), масло оранжевого цвета.
Спектр ЯМР 1Н (400,13 МГц, CDCl3), δ, м. д. (J, Гц): 0,65–0,70 м (3Н, CH3), 1,12–1,24 м (4Н, CH2), 1,57–1,65 м (1Н, CH2), 1,77–1,81 м (1Н, CH2), 4,23–4,30 м (1Н, SCH), 5,09–5,13 м (1Н, NCH2), 5,50 д.д (1Н, NCH2, J = 13,8, 7,7 Гц), 7,49–7,52 м (1Н, СPy), 8,12–8,16 м (1Н, СPy), 8,40–8,42 м (1Н, СPy), 9,49–9,51 м (1Н, СPy). Спектр ЯМР 13С (100,61 МГц, CDCl3), δ, м, д, (J, Гц): 13,75 (CH3), 27,84 (CH2), 36,36 (CH2), 40,01 (CH2), 53,35 (SCH), 60,86 (NCH2), 122,87 (Py), 122,91 (Py), 140,63 (Py), 143,75 (Py), 159,01 (NCSe, Py). Найдено, %: С 48,36, Н 6,00, N 5,34. C11H16BrNS. Вычислено, %: С 48,18, Н 5,88, N 5,11.
2-Пентил-2Н,3Н-тиазоло[3,2-a]пиридин-4-ий бромид (6). К раствору 2,2’-дипиридинилдисульфида 0,114 г (0,51 ммоль) в 10 мл хлористого метилена добавляли раствор 0,082 (0,51 ммоль) брома в 10 мл хлористого метилена. Через 5 мин добавляли по каплям раствор 0,101 г (1,03 ммоль) гептена-1 и перемешивали 20 ч при комнатной температуре. Растворитель удаляли на роторном испарителе, остаток сушили в вакууме. Выход 0,268 г (90 %), масло оранжевого цвета.
Спектр ЯМР 1Н (400,13 МГц, CDCl3), δ, м. д. (J, Гц): 0,76–0,78 м (3Н, CH3), 1,20–1,27 м (4Н, CH2), 1,40–1,52 м (2Н, CH2),1,91–1,96 м (2Н, CH2), 4,41–4,46 м (1Н, SCH), 5,12–5,26 м (1Н, NCH2), 5,44–5,56 м (1Н, NCH2), 7,70–7,72 м (1Н, СPy), 8,05–8,08 м (1Н, СPy), 8,14–8,17 м (1Н, СPy), 9,21–9,23 м (1Н, СPy). Спектр ЯМР 13С (100,61 МГц, CDCl3), δ, м. д. (J, Гц): 13,63 (CH3), 22,03 (CH2), 25,93 (CH2), 30,93 (CH2), 33,64 (CH2), 47,23 (SCH), 66,93 (NCH2), 123,82 (Py), 126,36 (Py), 143,36 (Py), 144,63 (Py), 158,33 (NCS, Py). Найдено, %: С 50,36, Н 6,43, N 4,96. C12H18BrNS. Вычислено, %: С 50,00, Н 6,29, N 4,86.
Результаты исследования и их обсуждение
В последние годы нами проводятся исследования, направленные на изучение реакций синтеза аннелированных сера- и селенорганических гетероциклов на основе халькогенсодержащих электрофильных реагентов [10]. Эффективным реагентом для получения производных тиазоло[3,2-a]пиридинов является 2-пиридинсульфенилхлорид [11, 12]. Использование 2-пиридинсульфенилбромида описано пока лишь в одной работе, где он используется в синтезе конденсированных соединений по реакции присоединения к двойной связи [11].
В продолжение этих исследований нами были изучены реакции 2-пиридинсульфенилгалогенидов с гексеном-1 и гептеном-1, ранее в литературе не описанные.
Взаимодействие 2-пиридинсульфенилгалогенидов с гексеном-1 и гептеном-1 приводит к аннелированию и образованию соответствующих бициклических конденсированных соединений. В работе [11] сообщается, что аналогичная реакция 2-пиридинсульфенилхлорида с циклоалкенами приводит к продуктам электрофильного присоединения, 1-(2-пиридинилсульфенил)-2-хлорциклоалканам, и аннелирования не происходит.
Установлено, что взаимодействие 2-пиридинсульфенилхлорида с гексеном-1 протекает в две стадии: сначала, при комнатной температуре в хлористом метилене, происходит электрофильное присоединение 2-пиридинсульфенилхлорида к двойной связи гексена-1 с образованием 2-[(2-хлорогексил)сульфанил]пиридина (1) с выходом 98 %. При кипячении соединения (1) в хлороформе в течение часа происходит внутримолекулярное нуклеофильное замещение хлора атомом азота пиридинового кольца, в результате которого образуется 2-бутил-2Н,3Н-тиазоло[3,2-a]пиридин-4-ий хлорид (2) (рис. 1).
Взаимодействие 2-пиридинсульфенилхлорида с гептеном-1 в аналогичных условиях протекает таким же образом и приводит сначала к продукту электрофильного присоединения 2-[(2-хлорогексил)сульфанил]пиридину (3), который затем вступает в реакцию аннелирования с образованием 2-пентил-2Н,3Н-тиазоло[3,2-a]пиридин-4-ий хлорида (4) (рис. 2).
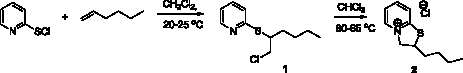
Рис. 1. Схема синтеза 2-бутил-2Н,3Н-тиазоло[3,2-a]пиридин-4-ий хлорида
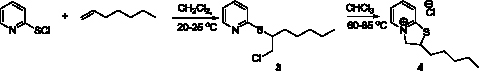
Рис. 2. Схема синтеза 2-пентил-2Н,3Н-тиазоло[3,2-a]пиридин-4-ий хлорида
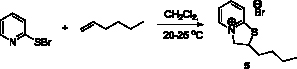
Рис. 3. Схема синтеза 2-бутил-2Н,3Н-тиазоло[3,2-a]пиридин-4-ий бромида
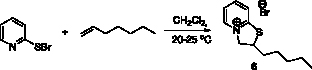
Рис. 4. Схема синтеза 2-пентил-2Н,3Н-тиазоло[3,2-a]пиридин-4-ий бромида
В этих реакциях присоединение атома серы 2-пиридинсульфенилхлорида происходит региоселективно по второму атому углерода алкена. Образования региоизомерных продуктов не наблюдается.
Нами было изучено взаимодействие 2-пиридинсульфенилбромида с гексеном-1 и гептеном-1. Установлено, что продуктом реакции 2-пиридинсульфенилбромида с гексеном-1 в аналогичных условиях является 2-бутил-2Н,3Н-тиазоло[3,2-a]пиридин-4-ий бромид (5) с выходом 96 % (рис. 3).
Аналогично был получен 2-пентил-2Н,3Н-тиазоло[3,2-a]пиридин-4-ий бромид (6) с выходом 90 % (рис. 4).
Следует отметить, что бромистые аналоги соединений (1) и (3) получены не были. Различие в поведении хлоридов и бромидов можно объяснить более высокой реакционной способностью промежуточных бромпроизводных по сравнению с аналогичными хлорпроизводными. Бромид-анион является лучшей уходящей группой по сравнению с хлорид-анионом, и внутримолекулярное нуклеофильное замещение брома атомом азота пиридинового кольца протекает уже при комнатной температуре и приводит к бициклическим конденсированным гетероциклам.
Строение синтезированных соединений доказано методом ЯМР 1Н и 13С и подтверждено данными элементного анализа.
Заключение
Таким образом, разработаны эффективные региоселективные методы синтеза производных 2,3-дигидро[3,2-а]тиазоло[3,2-a]пиридин-4-ия взаимодействием 2-пиридинсульфенилгалогенидов с гексеном-1 и гептеном-1. Полученные конденсированные гетероциклы представляют интерес как новые перспективные полупродукты с потенциальной биологической активностью.
Спектральные исследования проведены с использованием материально-технической базы Байкальского аналитического центра коллективного пользования СО РАН.
Библиографическая ссылка
Ишигеев Р.С., Шкурченко И.В., Потапов В.А., Зинченко С.В., Амосова С.В. СИНТЕЗ НОВЫХ КОНДЕНСИРОВАННЫХ ПРОИЗВОДНЫХ ПИРИДИНА // Международный журнал прикладных и фундаментальных исследований. – 2019. – № 10-2. – С. 351-355;URL: https://applied-research.ru/ru/article/view?id=12920 (дата обращения: 16.04.2024).

