Пастереллез – высококонтагиозное заболевание многих видов сельскохозяйственных, синантропных и диких животных, пушных зверей и птиц с высокой летальностью и тенденцией к стационарности. Решение проблемы борьбы с пастереллезом осложняется тем, что патогенные пастереллы длительное время сохраняются в организме не только переболевших и бывших с ними в контакте здоровых животных, но и в организме синантропных животных и птиц, создавая таким образом стационарный эпизоотический очаг [1–3]. Ежегодная регистрация пастереллеза у животных свидетельствует о напряжённости эпизоотической и эпидемической ситуации по данному заболеванию.
Таким образом, широкое географическое распространение пастереллеза, восприимчивость к нему всех видов домашних животных, многих диких млекопитающих и птиц, а также значительный ущерб, наносимый им отдельным животноводческим хозяйствам и даже целым районам, требует совершенствования лечебно-профилактических мероприятий [4].
Основным методом контроля пастереллеза является вакцинация с использованием адъювантных вакцин, содержащих инактивированные бактерии вида P. multocida. Недостатком данных вакцин является краткосрочность создаваемого ими иммунитета (менее 6 мес.) и необходимость ревакцинации для индукции необходимого протективного эффекта [5]. При этом отмечено, что данный тип препаратов предохраняет только от гомологичных серотипов P. multocida.
Использование в составе препаратов масляных адъювантов, значительно повышающих иммуногенность инактивированных вакцин, приводит к увеличению числа поствакцинальных осложнений, что связанно с высокой вязкостью масел и большим количеством инактивированных бактериальных клеток (1010–1011 микробных клеток) [6]. Несмотря на разработку новых масляных адъювантов со сниженной вязкостью, препараты на их основе не нашли широкого применения в связи со значительным повышением стоимости вакцин [7].
Живые слабовирулентные вакцины в сравнении с инактивированными, а также с живыми авирулентными пастереллами, обладают выраженной иммуногенностью и более эффективны как вакцина [8]. Преимуществом таких вакцин, помимо их высокой эффективности, является возможность их аэрозольного применения, что обеспечивает проведение массовых вакцинаций в короткие сроки в промышленном птицеводстве с минимальными затратами [9].
В настоящее время за рубежом созданы и проходят испытания живые вакцины против пастереллеза крупного рогатого скота, свиней, кроликов, птицы [10]. Основа таких вакцинных препаратов – аттенуированные штаммы возбудителя, полученные различными путями, в том числе – индуцированного мутагенеза и дальнейшего отбора мутантных производных возбудителя, устойчивых к антибиотикам. Антибиотикоустойчивые генетические маркеры позволяют дифференцировать вакцинные штаммы от полевых. Данный метод аттенуации имеет недостаток, связанный с высоким риском возврата к вирулентной форме [11].
В литературных источниках приводится альтернативный метод, обусловленный введением определенных ауксотрофных мутаций в ген AroA вирулентных штаммов пастерелл, что делает их авирулентными. Функция данного гена существенна для роста бактерий in vivo и для развития инфекционного процесса. На основе данного метода создан ряд коммерческих препаратов для профилактики пастереллеза КРС, буйволов и кур. Вакцинация AroA мутантными штаммами пастерелл приводит к невосприимчивости к заражению как гомологичными, так и гетерологичными штаммами P. multocida [12].
Цель данного исследования – получение генетически аттенуированного AroA мутантного штамма Pasteurella multocida.
Материалы и методы исследования
В работе использовали дикий тип P. multocida, выделенный на территории Алматинской области Республики Казахстан от теленка, погибшего во время вспышки пастереллеза. Указанный штамм пастерелл выращивали на средах Brain Heart Infusion Agar (BHIA) и Brain Heart Infusion Broth (BHIB) при 37 °С в течение 18–20 ч. Дикий тип P. multocida в дальнейшем использовали для получения AroA вакцины.
Репрезентативные колонии P. multocida высевали на BHIB без антибиотиков и выращивали при 30 °С в течение 16 ч. Проводили три 16 часовых последовательных пассажа культуры в 5 мл среды бульона BHIB и инкубировали при 30 °C, что способствует удалению плазмиды. Культуру объеме 10 мкл высевали на BHIA и инкубировали при 37 °С в течение 16 ч для изоляции колоний. Канамицин-чувствительные колонии анализировали с помощью ПЦР с P. multocida AroА парами праймеров, с целью исключения наличия данных вставок.
Канамицин-резистентные колонии высевали на среду M9, содержащую: фосфатный буффер, 1 m MMgSO4, 0,1 m MCaCI2, 0,2 % (w/v) глюкозы и 1,5 % (w/v) Нобель агара (Difco), тиамин (10мкг/мл), тирозин, триптофан, фенилаланин (по 40 мкг/мл) и 2,3 дигидробензойная кислота (10мкг/мл). Клоны способные расти на данной среде, относятся к АroA мутантам. Штамм Escherichia coli TOP 10 (Invitrogen) выращивали в бульоне LB, содержащем соответствующие антибиотики (ампициллин, 50 мкг/мл, и канамицин, 40 мкг/мл) в колбах при 150 об/мин, или на чашках с агаром LB в течение ночи при 37 °C.
Выделение и манипуляция ДНК
Хромосомная ДНК из P. multocida была выделена в соответствии Ausubel и др. [13]. Во всех манипуляциях использованы стандартные методы молекулярного клонирования, трансформации и электрофореза [14].
Получение аттенуированных рекомбинантных AroA мутантов P. multocida
Для получения AroA мутантов P. multocida были сконструированы две плазмиды, несущие в себе ген AroA с нарушенной функцией. В качестве исходной была взята нуклеотидная последовательность гена AroA штамма РВА100 P. multocida (номер в GenBank – Z14100). Кассета, кодирующая резистентность к канамицину, была получена путем вырезания PstI фрагмента размером 1240 п.н. из плазмиды pUC4K (Pharmacia).
Для получения первой плазмиды, которая имеет в качестве маркера ген устойчивости к канамицину, из AroA-гена был вырезан участок EcoRV/ClaI размером 302 п.н. (нуклеотиды 932-1233). Затем конструкция, кодирующая устойчивость к канамицину, была вставлена в ген AroA по уникальному сайту рестрикции NsiI. В результате получена последовательность, имеющая размер 2565 п.н., которую клонировали в плазмиду pBluescriptIISK(-) по сайтам рестрикции BamHI/PstI.
Для получения безмаркерной мутации из AroA-гена был вырезан участок EcoRV/ClaI размером 302 п.н. (нуклеотиды 932-1233). Данная последовательность была клонирована в плазмиду pBluescript II SK(-) по сайтам рестрикции PstI/SmaI.
Электропорация
Компетентные бактерии P. multocida (50 мкл) были смешаны с 200 нг плазмидной ДНК в кювете для электропорации. Также была взята 1 кювета с компетентными бактериями без добавления плазмидной ДНК. Смесь незамедлительно электропорировали после добавления ДНК (Genepulser; Bio-Rad) при 15,000 V/cm, 800 Ω и 25 мкF с постоянным результирующим временем, составляющим от 7,8 до 8,9 мс. К клеткам добавляли 150 мкл обогащенной среды SOC. Электропорированные клетки восстанавливали в течение 2 ч при 37 °С на шейкере с перемешиванием, после чего рассевали на BHIA с содержанием 50 мкг/мл канамицина и инкубировали в течение 24 ч при 30 °C.
Полученные единичные колонии (4–5 шт.) высевали на BHIB, содержащий 50 мкг/мл канамицина и инкубировали в течение 18 ч при температуре 30 °C. Полученный материал высевали на BHIA с канамицином (по 10 мкл на чашку) и инкубировали 16 ч при 40 °C для получения единичных колоний мутантов.
ПЦР анализ
Для амплификации последовательностей генов P. multocida использовали видоспецифичные праймеры KMTIT7 и KMTISP6, разработанные Townsend и др. [15]. Канамицин-чувствительные колонии анализировали с помощью ПЦР с P. multocida AroA парами праймеров KanF, KanR (483 п.н.) и AroAf, AroAr (988 п.н.), с целью исключения наличия данных вставок.
Постановка ИФА
Для выявления антител к бактериям P. multocida использовали набор Invitrogen «Super Script III One – Step RT – PCR with Platinum Tag»; прямой и обратный праймеры P. multocida AroA; прямой и обратный праймеры P. multocida Canamisin. Учет результатов реакции проводили на фотометре при длине волны 405 нм.
Определение вирулентности рекомбинантных штаммов
Для определения степени патогенности AroA мутантных клонов, использовали белых беспородных мышей 2–3 недельного возраста, живой массой 16–18 г. Для этого их заражали подкожно в область спины в объеме 0,5 см3 полученными мутантными клонами.
Результаты исследований и их обсуждение
Для получения AroA мутантов, согласно представленным в литературе методикам [16], требуется проведение многократных пассажей на средах, содержащих канамицин с клонированием канамицин-резистентных мутантов с последующим генетическим анализом. Отбор репрезентативных колоний проводили высевом трансформантов на BHIA с добавлением 10 мкг/мл канамицина. В результате высева отмечали рост более 200 колоний одного типа. Полученные единичные колонии (80 колоний) пассировали, чередуя жидкую среду BHIB и твердую среду BHIA с добавлением 10 мкг/мл канамицина.
В течение 30 пассажей 71 исследуемых клонов были исключены из экспериментов, так как при потере плазмиды происходила утрата их резистентности к антибиотику, вследствие чего пастереллы утратили способность к росту в канамицин-содержащих средах.
При анализе ПЦР оставшихся 9 клонов установлено, что все клоны относятся к виду Р. multocida (рис. 1).
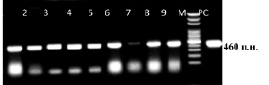
Рис. 1. Электрофореграмма ПЦР-продуктов клонов Р. multocida, содержащих AroA мутанты: 1 – клон № 4, 2 – клон № 6, 3 – клон № 7, 4 – клон № 8, 5 – клон № 9, 6 – клон № 10, 7 – клон № 11, 8 – клон № 16, 9 – клон № 17, М – маркер, РС – положительный контроль P. multocida
Рис. 2. Электрофореграмма ПЦР- продуктов клонов Р. multocida, содержащих AroA мутанты на канамицин резистентность: 1 – клон № 4, 2 – клон № 6, 3 – клон № 7, 4 – клон № 8, 5 – клон № 9, 6 – клон № 10, 7 – клон № 11, 8 – клон № 16, 9 – клон № 17, М – маркер, 50 п.н., Invitrogen
Рис. 3. Электрофореграмма ПЦР- продуктов AroA гена клонов Р. multocida: 1 – клон № 4, 2 – клон № 6, 3 – клон № 7, 4 – клон № 8, 5 – клон № 9, 6 – клон № 10, 7 – клон № 11, 8 – клон № 16, 9 – клон № 17, М – маркер, 1 kb, Invitrogen, С – контроль AroA гена
Из рис. 1 видно, что профили ПЦР-продуктов (460 п.н.) клонов Р.multocida, содержащих AroA мутанты соответствовали профилю исходного варианта P. multocida.
Клоны Р. multocida, содержащие AroA мутанты проверяли на канамицин-резистентность методом ПЦР (рис. 2).
Из рис. 2 видно, что профили ПЦР-продуктов (483 п.н.) Р. multocida, содержащих AroA мутанты указывают на соответствие канамицин-резистентности изучаемых клонов.
Клоны Р. multocida проверены на содержание AroA гена дикого типа (988 п.н.) и мутантного типа (1922 п.н.) (рис. 3).
Из данных рис. 3 видно, что ПЦР-продукты mutant type AroA гена (1922 п.н.) наработаны в клонах № 4, № 6, № 8 Р. multocida. Указанные клоны рекомбинантов были изолированы и использованы для дальнейших исследований.
По результатам ПЦР анализа получены следующие данные: при анализе на канамицин наблюдается наработка ПЦР продуктов размером 483 п.н.; на КМТ 1 ген – 460 п.н., что свидетельствует о принадлежности исследуемого материала к P. multocida. При постановке ПЦР на AroA ген выявлено, что при исследовании исходного материала (дикий тип) наработан продукт размером 988 п.н., а при изучении генетически аттенуированного штамма – продукт размером 1922 п.н. Последнее указывает на наличие генетической конструкции, вставленной в ген AroA P. multocida.
На следующем этапе проводили клонирование каждого рекомбинанта методом предельных разведений для получения единичных колоний. После чего по 10 колоний каждого рекомбинанта высевали на минимальную среду M9 (канамицин 10 мкг/мл) с добавлением тиамина, тирозина, триптофана, фенилаланина, 2,3-дигидробензойной кислоты, р-гидробензойной кислоты. По истечении 18–20 ч на среде M9 отмечали рост всех исследуемых субклонов.
В дальнейшем проводили изучение вирулентности рекомбинантных клонов Р. multocida № 4, № 6 и № 8 на мышах (таблица).
Уровень патогенности AroA мутантов для мышей
|
Испытуемый мутант |
МЛД 50, м.с. |
|
№ 4 |
5,4 ± 0,9×106 |
|
№ 6 |
4,5 ± 0,4×108 |
|
№ 8 |
3,2 ± 0,5×103 |
|
исходный (дикий тип) |
2,5 ± 0,7×10 |
Как видно из данных таблицы, уровень патогенности для всех испытанных мутантов клонов значительно различался. Наименее патогенным оказался клон № 6 – показатель МЛД 50 при его введении составил 4,5 ± 0,4×108 (м.к.). Таким образом, данный клон пригоден для использования в качестве вакцинного штамма.
Выводы
1. В результате проведенных исследований получены 3 клона штамма Р.multocida, содержащего мутантный AroA ген.
2. При изучении уровня их патогенности на белых мышах, наименее патогенными свойствами обладал клон № 6.
3. Указанный клон может быть использован в качестве вакцинного штамма-кандидата для профилактики пастереллеза.
Библиографическая ссылка
Далбаев Н.К., Кайсенов Д.Н., Султанкулова К.Т., Тайлакова Э.Т., Червякова О.В., Алиева А.Б., Абсатова Ж.С., Баракбаев К.Б. ПОЛУЧЕНИЕ ГЕНЕТИЧЕСКИ АТТЕНУИРОВАННОГО AROA МУТАНТНОГО ШТАММА PASTEURELLA MULTOCIDA // Международный журнал прикладных и фундаментальных исследований. – 2020. – № 3. – С. 7-11;URL: https://applied-research.ru/ru/article/view?id=13027 (дата обращения: 24.04.2024).

