В настоящее время исследование качества пищевых продуктов путем выявления в них неспецифической микрофлоры является актуальным для современной биологии и медицины. Размножение некоторых микроорганизмов приводит к непригодности пищевых продуктов к употреблению. Многие из производимых в мире продуктов не доходят до потребителя в связи с их порчей (в большинстве случаев микробами) [1–3].
Содержание в пищевых продуктах белков, углеводов, витаминов и других питательных веществ благоприятствует не только сохранению, но и размножению различных микроорганизмов [4, 5]. В молочнокислых и полученных путем брожения пищевых продуктах находятся в большом количестве микробы, которые придают им вкусовые качества и определенную консистенцию (специфическая микрофлора). Кроме того, в продуктах могут содержаться микроорганизмы или их споры, попавшие из внешней среды (неспецифическая микрофлора) [6–8].
В отдельных случаях пищевые продукты могут быть обсеменены сальмонеллами, шигеллами, стафилококками, клостридиями ботулизма, E. coli, B. cereus, Cl. perfringens и другими бактериями, приводящими к возникновению у людей пищевых токсикоинфекций и других заболеваний [9–11]. Поэтому актуально выявление и исследование культуральных, биохимических свойств микрофлоры пищи.
Целью нашего исследования явилось изучение биохимических свойств выявленных неспецифических микроорганизмов пищевых продуктов.
Материалы и методы исследования
Исследование проводилось в бактериологической лаборатории Департамента профилактики заболеваний и госсанэпиднадзора Кыргызской Республики. Объекты исследования – выявленная патогенная и условно-патогенная микрофлора пищевых продуктов.
Во время исследования использовали биохимические методы микробиологии (бродильный метод, методы определения лецитоветиллазы, индикаторные бумажные тесты) [12]. Определение бактерий группы кишечных палочек (БГКП) в пищевых продуктах производили бродильным методом посевом на среды Кесслера, – 37 °С – 18–24 ч., высев на Эндо – 37 °С – 24 ч. (ГОСТ 30518-97, ГОСТ 10444.15-94). Определение семейства Enterobacteriacea производили с помощью системы индикаторные бумажные (СИБ) тесты – индолообразования (СТ 28560-90, ГОСТ 30726-2001). А идентификацию Staphylococcus aureus – определением лецитоветиллазы (лецитиназа), реакцией плазмокоагуляция (ГОСТ 9225-84).
Результаты исследования и их обсуждение
Из молочных продуктов, кондитерских изделий и готовых кулинарных изделий выделены бактерии группы кишечных палочек. Характерные биохимические свойства бактерии группы кишечных палочек мы описываем ниже.
Для определения биохимических свойств БГКП 0,1 г продукта (разведение 1:10) высевали на 9 мл среды Кесслера с поплавками при температуре 37 °С и инкубировали на 16–24 ч. После инубации наблюдали выделение газа и изменение цвета среды. Цвет среды Кесслера изменился с красного на желтый. Это доказывает, что БГКП ферментировал среды Кесслера с образованием газа (рис. 1).


а) б)
Рис. 1. Биохимические свойства семейства Enterobacteriaceae: а) отрицательный, б) положительный (ферментировали среды Кесслера с образованием газа)
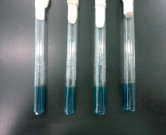

а) б)
Рис. 2. Биохимические свойства семейства Enterobacteriaceae: а) среда лактоза до посева, б) среда лактоза после посева
Затем, чтобы дальше исследовать биохимические свойства БГКП, производили посев на лактозную среду. После инкубации при температуре 37 °С на 24 ч на лактозной среде наблюдали выделение пузырьков и изменение цвета среды. Как видно на рис. 2, изменился цвет среды с темно-зеленого на желтый, выделение пузырьков доказывает, что эти микроорганизмы, ферментируя лактозную среду, образуют кислоту и газы.
Чтобы определить биохимические свойства E. coli, 0,1 г продукта (разведение 1:10) высевали на 9 мл среды Кесслера с поплавками при температуре 44 °С, инкубировали на 16–24 ч. После инкубации наблюдали выделение газа и изменение цвета среды. Цвет среды Кесслера изменился с красного на желтый. Это доказывает, что E. coli ферментировал среды Кесслера с образованием газа (рис. 1). Для дальнейщего исследования биохимических свойств E. coli производили посев на лактозную среду. После инкубации при температуре 37 °С на 24 ч на среде лактоза наблюдали выделение пузырьков и изменение цвета лактозной среды. Цвет лактозной среды изменялся с темно-зеленого на желтый и выделялись газы. Эти свойства характерны для семейства Enterobacteriaceae (рис. 2).
Для межродовой и видовой биохимической дифференциации энтеробактерий определяли с помощью системы индикаторные бумажные тесты (СИБ-тесты).
Биохимические свойства группы Proteus определяются с помощью СИБ-тестов. После инкубации наблюдали следующие изменения. Результат анализа регистрировался визуально. При определении оксидазной активности группы Proteus СИБ тест меняет свой цвет на синий. Это доказывает, что эти выросшие культуры на поверхности агара группы Proteus.
Из колонии группы Proteus vulgaris брали бактериологической петлей и посевали штрихом по косяку и уколом в столбик комбинированной среды для первичной биохимической идентификации микробов на среду Клиглера (1) и Симонса (2) (Проба № 2118-2121, рис. 3). На рис. 4 видно, что идет почернение среды Клиглера, образование сероводорода, ферментация глюкозы с изменениями окраски столбика среды, кислотообразования. А среда Симонса не изменилась. Почернение среды Клиглера, появляющееся в средней или нижней части столбика, происходит при образовании выделенным микробом сероводорода, что свойственно представителям рода Рroteus vulgaris, Р. mirabilis.

Рис. 3. Биохимические свойства Proteus vulgaris. Среда Клиглера (1) и Симонса (2) до пересева

Рис. 4. Биохимические свойства Proteus vulgaris. Среда Клиглера (1) и Симонса (2) после пересева
При проведении дополнительного биохимического анализа Proteus vulgaris определяли индолообразование. Для выявления индола в пробирки разливали 6 мл среды и засевали суспензией бактерий. Инкубировали при температуре 37 °С в течение 18–24 ч. Затем для определения индола складывали по намеченной на ней линии вдвое и пинцетом опускали на дно пробирки. Контроль произвели СИБ-диской, помещенной в пробирку со стерильным натрия хлорида раствором 0,9 %. Обе пробирки инкубировали при температуре (37 ± 1) °С. На пробе индолообразования подтверждено, что конец индола окрашивался в розово-малиновый цвет.
Staphylococcus aureus в анаэробных условиях ферментирует маннит. Биохимические свойства Staphylococcus aureus определяли с помощью лецитоветиллазы и плазмокоагуляции. При определении лецитоветиллазы (лецитиназа) посевали на среду желточно-солевой агар – хлористый натрий является элективным фактором, он подавляет рост большинства представителей другой микрофлоры, главным образом грамотрицательной. Одним из компонентов яичного желтка является лецитовителлин. Лецитовителлин является субстратом для фермента лецитовителлазы (лецитиназы), относящегося к группе липаз и продуцируемого некоторыми стафилококками. На желточно-солевом агаре (рис. 5) колонии Staphylococcus aureus – S-формы, выпуклые, круглые и блестящие. Наличие пигмента легко определяется на глаз. Вокруг колонии S. аureus образовался радужный венчик. Это доказывает, что S. aureus обладает лецитовителлазной активностью.
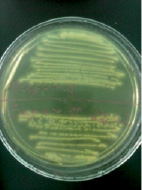
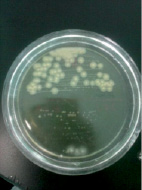
Рис. 5. Биохимическая идентификация Staphylococcus aureus
Для окончательной идентификации Staphylococcus aureus определяли фермент плазмокоагулазы. В пробирку, содержащую цитратную плазму крови, вносили с петлей суточной агаровой культуры исследуемого штамма и штатив с пробирками инкубировали на 4 часа в термостат при 37 °С. После инкубации учитывали результат, в пробирке (рис. 6) появился студнеобразный сгусток. Под действием фермента плазмокоагулазы активируется естественная система свертывания крови (плазминоген протромбин). Появление студнеобразного сгустка любого размера считается положительным результатом реакции. Положительным результатом следует считать наличие плазмокоагуляции в первые 4 часа инкубации. Отсутствие свертывания плазмы в течение 18 ч расценивается как отрицательный результат. В качестве контроля рекомендуется ставить реакцию с заведомо коагулирующим и некоагулирующим штаммами, а также оставлять одну пробирку с плазмой незасеянной (рис. 6).

Рис. 6. Биохимические свойства Staphylococcus aureus. Реакция плазмокоагуляции
Выводы
1. Показано, что семейства Enterobacteriaceae ферментируют углеводы с кислотообразованием и выделяют сероводород.
2. Установлено, что Staphylococcus aureus ферментирует лецитовителлин и активирует естественную систему свертывания крови и вызывает плазмокоагуляцию.
3. Показано, что Proteus vulgaris обладает сахаролитической и протеолитической активностью.
Библиографическая ссылка
Бейшеналиева С.Т., Кырбашова М.Т. БИОХИМИЧЕСКИЕ СВОЙСТВА ПАТОГЕННЫХ И УСЛОВНО-ПАТОГЕННЫХ МИКРООРГАНИЗМОВ ПИЩЕВЫХ ПРОДУКТОВ // Международный журнал прикладных и фундаментальных исследований. – 2020. – № 12. – С. 7-11;URL: https://applied-research.ru/ru/article/view?id=13151 (дата обращения: 25.04.2024).

