Основные принципы создания имплантатов нового поколения заключаются в разработке носителей из биодеградируемых материалов, используемых в сочетании с донорскими клетками и/или с биоактивными веществами. Основная функция таких материалов – обеспечение опорной и/или структурообразующей функции в поврежденной области ткани или органа. Наиболее подходящим заменителем биоапатита считается гидроксиапатит, который должен быть похожим на своего природного «собрата», т.е. представлять собой пластинчатые кристаллы малого размера (50 нм) и иметь в своем составе карбонат-ион [2, 3], так как именно кристаллографические характеристики природных и синтетических гидроксиапатитов играют одну из решающих ролей в процессах биологической минерализации. Поэтому исследования, направленные на определение фазового состава кальцийфосфатных имплантационных материалов, являются важной составляющей процесса изучения характеристик, определяющих свойства этих материалов в очаге замещения костной ткани.
Цель исследования – изучить качественный состав и структурные характеристики кальцийфосфатных материалов и их влияние на элементный состав костной ткани.
Материалы и методы исследования
Имплантационные материалы представляли собой композицию кальцийфосфатных соединений (КФС) и низкомолекулярных неколлагеновых белков (ННКБ), выделенных из костной ткани быков. Сырье для получения имплантационных материалов отвечало всем требованиям санитарно-эпидемиологической службы.
Минеральную составляющую имплантационных материалов получали из предварительно очищенной и измельченной костной ткани быков. Деминерализацию костной ткани проводили раствором соляной кислоты, для последующего осаждения из полученных растворов фосфатов кальция применяли растворы щелочей [6].
Для выделения ННКБ костную ткань быков очищали от остатков костного мозга, обезжиривали и измельчали. Затем проводили деминерализацию полумолярной хлороводородной кислотой. В результате этого в раствор экстрагировались неколлагеновые кислоторастворимые белки костной ткани. После диализа против дистиллированной воды образовывался нерастворимый в воде G1-гликопротеин и в растворе оставались белки костной ткани. Полученные лиофильно высушенные белки подвергались разделению по молекулярной массе с помощью гельпроникающей хроматографии на носителях СПС «Био-гидрокси» (Санкт-Петербург). Для дальнейшего разделения использовали фракции с молекулярной массой 10 кДа. В результате применения ионообменной хроматографии выделяли две фракции: 1 – не имеющую сродства к ионообменникам (КБО); 2 –. имеющую сродство к катионообменнику (КБК) Выделенные ННКБ растворяли в физиологическом растворе и смешивали с минеральной составляющей.
Полученный имплантационный материал помещали во флакон, укупоривали резиновой пробкой и алюминиевым колпачком, стерилизовали посредством β-излучения с дозой облучения в 20 кГр на линейном резонансном ускорителе электронов ЛУЭ-8-5В (С-Петербург, Россия).
Готовый имплантационный материал имел следующий количественный состав:
- минеральная составляющая в виде кальцийфосфатных соединений – 65-67 г;
- органическая составляющая в виде костных белков – 0,2 -0,3 г;
- физиологический раствор – до 100 г.
Исследование качественного состава полученных соединений проводили с использованием инфракрасной спектроскопии (ИКС) на приборе «Инфралюм ФТ-02» фирмы «Люмэкс» (Россия).
Структуру нативной кости и КФС изучали с помощью дифрактометрического анализа (ДА) на дифрактометре «ДРОН-7» с использованием CuКα1 излучения, Ni-фильтра, при длине волны λ = 1,54056 Å в интервале 10º≤2θ≤90º, с шагом 0,02º и экспозицией 15с, при температуре 298 Ко. Для анализа дифрактограмм использовали программный комплекс PDWin 4.0. Идентификацию соединений осуществляли путем сопоставления экспериментальных значений межплоскостных расстояний и относительных интенсивностей дифракционных максимумов с набором табличных значений для соответствующих кристаллических структур с применением «Порошкового дифракционного файла JCPDS ICDD PDF 2». Для определения фазового состава минеральной составляющей материала использовалась элементная подбаза «Р,Сa,Na,Mg,C,O,F,Cl,H».
Для исследования влияния разработанных материалов на элементный состав костной ткани беспородным собакам обоего пола в возрасте от одного года до трех лет с массой тела 10,2±2,4 кг в условиях операционной под внутривенным барбитуровым наркозом создавали несквозные дефекты в виде усеченных конусов диаметром 5 мм и высотой 7 мм в проксимальных метафизах большеберцовой и плечевой костей и заполняли их композициями на основе КФС (операции выполнены к.в.н. Емановым А.А.). Животные были распределены на две группы. В первой группе (n=11) костные дефекты заполняли КФС+КБО; во второй группе (n=11) – КФС+КБК. Эвтаназию животных проводили внутривенным введением 5 %-го раствора тиопентала натрия в летальных дозах через 21 и 42 суток после операции.
Содержание животных, оперативные вмешательства и эвтаназию осуществляли согласно требованиям приказа МЗ СССР № 755, 1977 г., а также руководствуясь требованиями, изложенными в «Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях» с соблюдением этических норм и гуманного отношения к объектам изучения.
Для гистологического исследования использовали недекальцинированный материал, полученный из фрагментов проксимальных метафизов большеберцовых и плечевых костей, включающих области сформированных дефектов. После фиксации и проводки материала изготавливали аралдитовые блоки и с помощью рентгеновского электронно-зондового микроанализатора «INCA» (фирма OXFORD INSTRUMENTS, Англия), определяли содержание химических элементов (вес. %) – кальция (Са), фосфора (Р), магния (Mg), серы (S) – в костной ткани, формирующейся в полости дефекта, а также в окружающей его костной ткани. В каждой группе на всех сроках эксперимента определяли содержание перечисленных элементов в участке метафиза, удаленного от зоны дефекта. Анализ полученных данных показал, что содержание элементов на протяжении всего периода наблюдения существенно не изменялось, значимых различий, как между группами, так и по срокам эксперимента не выявлено, поэтому они были объединены в одну выборку и использованы в качестве контроля.
Статистическую обработку результатов выполняли с помощью программ «Microsoft Excel – 2010» и программного обеспечения для анализа и обработки данных «AtteStat» Версия 1.0, [1]. Цифровые данные представлены в виде медианы и 25 % и 75 % квартилей (Me (25 %;75 %)). Для оценки статистической значимости различий между группами применяли критерий Вилкоксона. Различия считали существенными при р<0,05.
Результаты исследования и их обсуждение
По результатам ИКС КФС (рис. 1) установлено, что оно характеризуется наличием полос поглощения различной интенсивности в областях волновых чисел, которые говорят о следующем: в данном соединении имеются группы (PO4) 2- (полосы поглощения при волновых числах 550-630 см-1 соответствуют деформационным колебаниям группы - P-O, при которых происходят движения с изменением величины угла между двумя связями; полоса поглощения при волновых числах 1000-1120 см-1 соответствует валентным колебаниям группы - P-O-, при которых движения происходят вдоль валентной связи); гидроксильные группы - OH (для них характерны полосы поглощения при 1594 см-1 - OH деформационные; при 3250-3600 см-1 - OH свободные и ассоциированные); карбонат-ионы -CO32- (полосы поглощения при волновых числах 850-900; 1370-1450 см-1; при 1410-1480 см-1 - C-O валентные, менее интенсивные, чем P-O деформационные и валентные колебания); карбоксильные группы - COO - (полосы поглощения при 1600 см-1 и 1400 см-1 соответствуют двум основным колебаниям карбоксильной группы); амиды - (при 1650 см-1 - деформационные колебания группы NH; при 3000-3500 см-1 - полоса обусловлена ионным диполярным состоянием молекулы: в высокочастотной области - валентными колебаниями NH2+ и NH3+) [5].
Следовательно, минеральная составляющая разработанных материалов представляет собой фосфатное соединение кальция с примесями в виде небольшого количества карбонатов (невысокая интенсивность полос поглощения) и белковых соединений, представленных в довольно большом количестве. По нашему мнению, это костные неколлагеновые белки, соосадившиеся вместе с минеральными солями кальция.
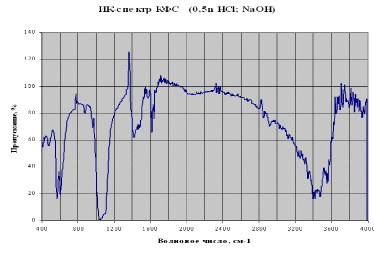
Рис. 1. Инфракрасный спектр поглощения КФС
При анализе профилей дифрактограмм (рис. 2) установлено, что образцы КФС имеют сходство с образцами костной ткани. В образцах КФС отмечено увеличение интенсивности пиков, улучшение их разрешения, уменьшение их ширины по сравнению с образцами костной ткани, что говорит о более высокой степени кристалличности по сравнению с нативной костью.
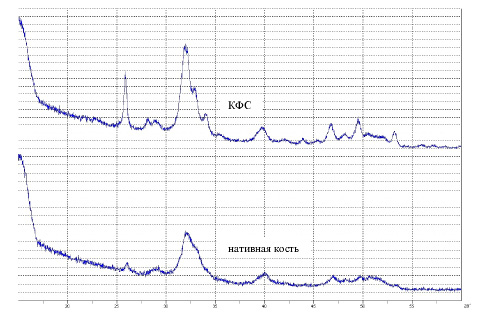
Рис. 2. Дифрактограмма образцов КФС и нативной кости
В состав, как образцов костной ткани, так и КФС входят карбонат-ионы, Cl-, F- и другие неорганические ионы, замещающие различные позиции в кристаллической решетке гидроксиапатита (ГА). Частично пики разных соединений перекрываются (табл. 1).
Таблица 1
Качественный и количественный состав кристаллической фазы КФС и нативной кости
|
КФС |
Нативная кость |
|
Сa5(PO4)3(OH) (карточка 9-432 Hydroxyapatite Hydroxyapatite) ~ 16.8 % |
Сa5(PO4)3OH (карточка 9-432 Hydroxyapatite) ~ 30.5 % |
|
Сa5(PO4)3(OH, Cl, F) (карточка 25-166 Hydroxyapatite, chlorian Hydroxyapatite, chlorian Hydroxyapatite, chlorian) ~ 14.6 % |
Сa5(PO4)3(OH, Cl, F) (карточка 25-166 Hydroxyapatite, chlorian) ~ 18.3 %
|
|
Сa5(PO4)3F (карточка 15-867 Fluorapatite Fluorapatite) ~ 14.1 % |
- |
|
Сa10(PO4)6(OH)2 (карточка 1-1008 Hydroxyapatite) ~ 13.7 %, |
Сa10(OH)2(PO4)6 (карточка 1-1008 Hydroxyapatite) ~ 26.3 % |
|
Сa5(PO4)3F (карточка 12-261 Fluorapatite) ~ 12.8 % |
- |
|
Сa5(PO4)3Cl (карточка 24-14 Chlorapatite) ~ 12 % |
Сa5(PO4)3Cl (карточка 2-851 Chlorapatite) ~ 8.3 % |
|
Сa10(PO4)3(CO3)3(OH)2 (карточка 19-272 Carbonatehydroxyapatite Carbonatehydroxyapatite) ~ 11.1 % |
Сa10(PO4)3(CO3)3(OH)2 (карточка 19-272 Carbonatehydroxyapatite) ~ 16.6 % |
|
СaMg(CO3)2 (карточка 11-78 CarbonateHydroxyapatit) ~ 4.8 % |
- |
По данным электронно-зондового микроанализа кальцийфосфатное соединение, составляющее основу КФС+КБО и КФС+КБК, представлено шестью химическими элементами (рис. 3), соотношение которых на этапах эксперимента существенно не изменялось. Неколлагеновые костные белки также не оказывали влияния на его элементный состав.
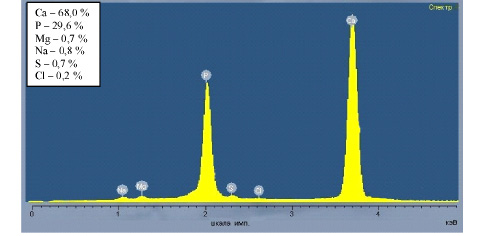
Рис. 3. Спектр поверхности и соотношение химических элементов, составляющих КФС
Морфологически КФС представляет собой мелкозернистую порошкообразную массу с единичными включениями в виде гранул диаметром до 2,76 мм (рис. 4).

Рис. 4. Сканограмма поверхности КФС. Увеличение 1000
При гистологическом исследовании установлено, что заполнение дефекта новообразованной костной тканью происходило по направлению от его края к центру. Через 21 сутки после заполнения дефектов имплантационными материалами по данным рентгеновского электронно-зондового микроанализа содержание кальция и фосфора в костной ткани регенератов обеих групп было значимо ниже контрольных значений (табл. 2). Отмечалось неравномерное распределение кальция и фосфора в различных участках регенерата, их наибольшую концентрацию наблюдали в периферических отделах дефекта.
К 42 суткам эксперимента у животных обеих групп концентрация кальция и фосфора в костных трабекулах регенерата увеличивалась, что приводило к отсутствию значимых различий с контролем.
Содержание магния и серы в новообразованной костной ткани регенерата у животных из группы КФС+КБК уже через 21 сутки не отличалось от контрольных значений. В группе КФС+КБО, напротив, установлены значимые различия с контролем. Известно, что катион магния активирует фермент щелочную фосфатазу, участвующую в минерализации вновь образуемой костной ткани [3]. Содержание серы в костной ткани может косвенно свидетельствовать об изменении содержания сульфатированных гликозаминогликанов, которые способствуют накоплению кальция в созревающей костной ткани [7].
Сопоставление данных рентгеновского электронно-зондового микроанализа с морфологической картиной показало, что элементный состав новообразованной костной ткани зависел от степени ее зрелости.
При исследовании костной ткани, окружающей дефект, установлено снижение содержания кальция и фосфора в группе КФС+КБО через 21 сутки после операции (табл. 2). В группе КФС+КБК значимые отличия от контроля в содержании анализируемых элементов в костной ткани, окружающей дефект, отсутствовали. Полученные результаты свидетельствуют о том, что при имплантации КФС+КБК мобилизация анализируемых химических элементов из костной ткани, прилегающей к дефекту, в регенерат не существенна. В данном имплантационном материале органическая составляющая представлена ННКБ, обладающими сродством к катионообменникам и свойствами инсулиноподобного фактора роста [4], которые совместно с гормоном роста участвуют в регуляции репаративных процессов в костной ткани, обладают способностью стимулировать процессы пролиферации, дифференцировки и метаболизма костных, мышечных, нервных, эритроидных клеток и фибробластов, а через взаимодействие со специфическими рецепторами стимулируют выработку коллагена и белков экстрацеллюлярного матрикса в остеобластах и остеоцитах [8, 9].
Таблица 2
Содержание химических элементов в костной ткани
|
Срок эксперимента |
Химический элемент, вес. % |
|||
|
Ca (кальций) |
P (фосфор) |
Mg (магний) |
S (сера) |
|
|
группа «КФС+КБО» (костная ткань регенерата / костная ткань, окружающая полость дефекта) |
||||
|
21 сутки |
13,45*** (11,79; 14,98) / 16,73* (15,37; 17,81) |
5,74* (4,86; 6,42) / 7,22* (6,76; 7,75) |
0,22* (0,18; 0,26) / 0,24 (0,20; 0,26) |
0,28*** (0,25; 0,32) / 0,26 (0,22; 0,28) |
|
42 сутки |
17,33 (16,65; 19,40) / 19,17 (17,82; 20,40) |
7,54 (6,57; 8,61) / 8,50** (7,69; 9,20) |
0,23 (0,17; 0,26) / 0,30* (0,26; 0,31) |
0,23 (0,15; 0,31) / 0,27 (0,19; 0,34) |
|
группа «КФС+КБК» (костная ткань регенерата / костная ткань, окружающая полость дефекта) |
||||
|
21 сутки |
15,64*** (11,87; 16,74) / 18,10 (16,90; 19,71) |
6,89*** (5,02; 7,78) / 7,97 (6,87; 8,64) |
0,26 (0,21; 0,28) / 0,26 (0,22; 0,28) |
0,25 (0,18; 0,33) / 0,23 (0,21; 0,29) |
|
42 сутки |
16,87 (14,79; 18,45) / 17,32 (16,54; 18,42) |
7,55 (6,32; 8,30) / 7,91 (7,51; 8,06) |
0,23 (0,21; 0,26) / 0,25 (0,22; 0,26) |
0,23 (0,18; 0,28) / 0,21* (0,18; 0,23) |
|
контроль |
17,46 (15,91; 18,92) |
7,52 (6,85; 8,43) |
0,23 (0,20; 0,27) |
0,25 (0,19; 0,30) |
Различия значимы по сравнению с контролем: * – р<0,05; ** – р<0,01; *** – р<0,001.
Заключение
Результаты проведенного исследования показали, что основной кристаллической фазой образцов разработанного КФС является гидроксиапатит с характерными дифракционными рефлексами. В композиции с ННКБ, имеющими различное сродство к ионообменникам, имплантируемый материал создает благоприятные условия для минерализации костной ткани регенерата, формирующегося в полости дефекта, а также снижает мобилизацию анализируемых элементов из костной ткани, прилегающей к дефекту, что свидетельствует о перспективности его применения в ортопедии.
Библиографическая ссылка
Лунева С.Н., Талашова И.А., Осипова Е.В., Накоскин А.Н. КАЧЕСТВЕННЫЙ И СТРУКТУРНЫЙ АНАЛИЗ КАЛЬЦИЙФОСФАТНЫХ МАТЕРИАЛОВ И ИХ ВЛИЯНИЕ НА ЭЛЕМЕНТНЫЙ СОСТАВ КОСТНОЙ ТКАНИ // Международный журнал прикладных и фундаментальных исследований. – 2014. – № 8-3. – С. 95-100;URL: https://applied-research.ru/ru/article/view?id=5756 (дата обращения: 19.04.2024).

