Гидрирование бензола на Nі-Sn. Rh-Sn и Ru-Sn катализаторах. Сопоставление данных по активности металлов в процессах превращений углеводородов представляется весьма сложным из – за различия применяемых методик, условий экспериментов и критериев оценки активности. по этой причине найболее целосообразным является приведение данных, в которых такое сопоставление проводится в идентичных условиях. В нашей работе остановимся на каталической активности индивидуальных металлов VIII группы. Найболее удобным и распространенным объектом для оценки активности разных катализаторов является гидрирование бензола [1-5].
Гидрирование бензола и его гомологов в жидкой фазе в промышленных условиях чаще всего осуществляют с использованием скелетного никелевого катализатора. Представляет интерес сопоставить активность нами приготовленных нанесенных биметаллических систем и промышленного скелетного никелевого катализатора в этом процессе. Опыты проводили в статическом реакторе (аппарат Вишневского) в интервале температур 100-200°С и давлении водорода 2-10 МПа. Размеры гранул, измеренные на гранулометрическом счетчике частиц ТА-ІІ «Coulter», составляли для Ni- Sn, Rh- Sn, Ru- Sn систем не более 60; 60 и 40 мкм, соответственно.
Специальными опытами было доказано отсутствие внутренне и внешнедиффузионного торможения, т.е. протекание реакции в изученных условиях в кинетической области.
Исследовали катализаторы, содержащие Ni (17,6 мас. %), Rh (1 мас. %) и Ru (1 мас. %), а также Ni- Sn, Rh- Sn, Ru- Sn различного состава [4].
Предварительными опытами было показано, что олово не адсорбирует бензол и его гомологи и не проявляет каталитической активности в данном процессе в изученных условиях. На всех катализаторах в широком интервале изменения степени превращения сохранялась линейная зависимость ее от времени, т.е. выполнялось кинетическое уравнение нулевого порядка.
В табл. 1 суммированы результаты измерений активности Ni-Sn, Rh-Sn, Ru-Sn катализаторов различного состава в реакции жидкофазного гидрирования бензола. Скорость реакции отнесена к 1 г активной фазы основного металла. Для сравнения приведены данные для катализатора Ni Ренея [5].
Таблица 1
Влияние олова на активность катализаторов гидрирования бензола (160°С, Р=4 МПа, m = 0,60 г., объем реактора 200 мл)
|
Система |
Скорость реакций, моль/г мин, при содержании Sn, ат. % |
|||||
|
0,0 |
2,0 |
3,8 |
9,1 |
12,5 |
33,3 |
|
|
Ni- Sn |
1,1 |
0,7 |
0,6 |
0,5 |
0,4 |
0,2 |
|
Ru- Sn |
5,1 |
3,3 |
1,7 |
0,8 |
0,3 |
0,1 |
|
Rh- Sn |
11,4 |
14,6 |
12,1 |
11,2 |
8,8 |
1,3 |
|
Ni – скелетный |
0,1 |
- |
- |
- |
- |
- |
Модифицирование Ni- и Ru оловом во всех случаях уменьшает скорость реакции. В случае Rһ при содержании олова 2,0 ат. % наблюдается небольшое увеличение каталитической активности по сравнению с активностью индивидуального металла. Активность всех нанесенных систем, отнесенная к единице массы активной фазы металла, во всех случаях значительно превышает актавность скелетного Ni катализатора, что говорит об их высокой эффективности в этом процессе. Результаты испытаний образцов Ni- Sn и Ni- скелетного катализатора на пилотной установке в Институте угля СО АH РФ (г.Кемерово) подтвердили данных лабораторных исследований [4]. Было также найдено, что введение олова увеличивает термостабильность системы (спекание частиц металла происходит при более высоких температурах), и, как следует из табл. 2, увеличивает степень восстановления никеля.
Исследование активности биметаллических катализаторов в газовой фазе проводили в проточно-циркуляционной системе [4].
На рис.1 представлена зависимость скорости (W) гидрирования бензола в газовой и жидкой фазах от состава Rһ-Sn катализаторов, а на рис. 2 – от состава Ni – Sn и Ru – Sn систем. С увеличением концентрации олова в Ni- Sn катализаторах происходит уменьшение наблюдаемой активности [5]. Как видно из табл. 2 при увеличении содержания Sn число оборотов (т.е. число превратившихся молекул в 1 с отнесенное к одному центру поверхности) практически не изменяется (за исключением образца 50 % Sn), хотя количество поверхностных атомов Ni уменьшается.
Это означает, что гидрирование бензола протекает только на металлическом никеле. Из сравнения рис. 1 и 2 видно, что в отличне от Ni- Sn и Ru – Sn систем скорость реакции на Rh-Sn катализаторах в зависимости от их состава проходит через максимум при малых концентрациях Sn.
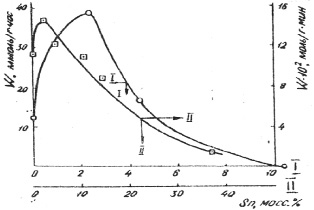
Рис. 1. Зависимость скорости реакции газофазного (I) жидкофазного (II) гидрирования бензола от состава Rһ-Sn катализаторов
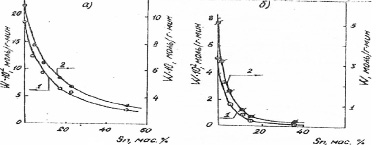
Рис. 2. Зависимость скорости реакции жидкофазного гидрирования бензола от состава Ni- Sn (а) и Ru.-Sn (б) катализаторов: 1 – скорость реакции, отнесенная к 1 г катализатора; 2 – скорость процесса, отнесенная к 1 г активного металла
Гидрогенолиз н-гексана. Как следует из адсорбционных и физико-химических исследовании, при модифицировании металлов VIII группы оловом происходит изменение размера частиц благодарного металла: в случая Ni наблюдается рост размера кристаллитов, для Rһ наборот, значительное уменьшение размеров частиц [4].С целью дальнейшего изучения взаимодействия компонентов бинарной системы и, в частности, для выяснения возможности проявления в данных системах кластерного и лигандного эффектов, мы исследовали каталические свойства Ni- Sn и Rh- Sn катализаторов в структурно-чувствительной реакции гидрогенолиза н-гексана. Проанализируем полученные данные и сопоставим их с результатами по каталитической активности данных систем в реакции гидрирования.
Реакцию гидрогенолиза н-гексана изучали в газовой фазе при атмосферном давлении в безградиентной проточно-циркуляционной установке при температурах 220°С на Ni- Sn и 350°С на Rһ-Sn катализаторах. Исходное парциальное давление н-гексана составляло 8 кПа.
Сравнение каталитической активности образцов различного состава проводили при одинаковой степени превращения, полученные данные представлены на рис. 3.
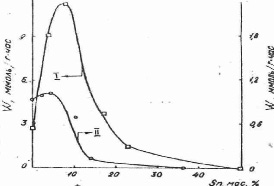
Рис. 3. Зависимость скорости реакции гидрогенолиза н –гексана от состава Nі- Sn (I) Rh- Sn (II) катализаторов
Активность Nі-Sn катализаторов возрастает при введении малых количеств Sn. Активность образца, содержащего 7,5 мас. % Sn, превышает активность чистого никеля в 4~ раза. Дальнейшее увеличение концентрации Sn сопровождается резким уменьшением скорости процесса. Таким образом, наблюдается синергический эффект. Проявление такого эффекта в реакции гидрогенолиза н-гексана при отсутствии его в реакции гидрирования бензола (см.рис. 2), по-видимому, связано с различием числа и свойств центров поверхности, ответственных за эти процессы.
Положение максимума на кривой (см. рис. 3) соответствует 7,5 % масс. Sn. Необходимо отметить, что при этом размеры кристаллитов никеля (см.табл.2) изменяются незначительно (от 30 до 40 Å) [1].
Таблица 2
Структура и адсорбционные свойства Ni- Sn систем
|
Структура Sn в масс % |
аН2 мкмоль/г |
аО2 мкмоль/г |
Размеры кристаллитов A0 |
|||
|
По хемосорбций |
Рентгеновские данные |
По электр. микроскоп.данным |
||||
|
Н2 |
О2 |
|||||
|
0,0 |
253 |
402 |
32 |
33 |
<30 |
17-30 |
|
3,9 |
219 |
386 |
40 |
37 |
30 |
18-30 |
|
7,5 |
229 |
485 |
55 |
44 |
40 |
30-35 |
|
16,8 |
159 |
430 |
90 |
56 |
60 |
- |
|
22,4 |
120 |
507 |
127 |
50 |
60 |
- |
|
50,0 |
27 |
330 |
650 |
90 |
~130 |
- |
аН2 и аО2 – количество хемосорбированного водорода и кислорода.
Действительно, гидрирование бензола в изученных условиях представляет собой структурно-нечувствительную реакцию и при хемосорбции бензола образуются поверхностные π-комплексы, связанные с одним центром. Гидрогенолиз же является структурно-чувствительной реакцией, которая протекает на сравнительно небольшой части поверхности, на центрах, прочно связывающих реагирующие молекулы. При этом осуществляется многоточечная адсорбция за счет образования σ-связей с поверхностью, а активный центр имеет сложную структуру. Промотирование никеля малыми количествами олова может изменять в первую очередь энергетику наиболее адсорбционно-способных центров поверхности благодаря образованию поверхностного сплава Nі – Sn (не фиксируемого рентгеновским методом) еще на стадии высокотемпературного восстановления образца. Так как размеры кристаллитов никеля в области максимума каталитической активности изменяется незначительно (см. табл. 3), то можно сделать вывод, что в данной системе определяющим является электронное взаимодействие компонентов (лигандный эффект) биметаллических систем.
Значительное уменьшение скорости процесса, которое наблюдается после максимума (см. рис. 3), можно объяснить образованием крупных частиц интерметаллидов, неактивных в реакции гидрогенолиза.
Таблица 3
Характеристика систем Rh- Sn систем
|
Sn, масс % |
аН2, мкмоль/г |
Размеры кристаллитов, A0 по электронно-микроскопическим данным |
|
0,0 |
21,5 |
22-28 |
|
2,3 |
20,3 |
19-24 |
|
4,5 |
12,5 |
<20 |
|
10,5 |
0,6 |
- |
|
14,5 |
0,0 |
- |
аН2– количество хемосорбированного водорода.
Небольшие синергические эффекты, наблюдающиеся в процессах гидрирования бензола (рис. 1) и гидрогенолиза н-гексана (рис. 3) на Rh-Sn системах также в области малых концентраций Sn, могут быть обусловлены увеличением дисперсности активного металла при введении олова (см. табл. 3).
Выводы
При небольших добавках олова (3,8 ат. % в случае Nі-Sn и 2,3 ат. % для Rh-Sn) наблюдается значительное увеличение каталитической активности образцов. В Nі- Sn системе синергический эффект проявляется в реакции гидрогенолиза н-гексана, но отсутствует в реакции жидкофазного гидрирования бензола.
На Rh-Sn катализаторах этот эффект наблюдается в обеих реакциях. Результаты свидетельствуют о наличии электронного взаимодействия между компонентами бинарной Nі-Sn системы (лигандный эффект), способствущего усилению только гидрокрекирующей активности металла. Происходящие в результате введения олова, изменения свойств немногочисленных центров поверхности: ответственных за процесс гидрогенолиза, не сказываются на скорости гидрирования бензола, протекающей на всей поверхности активной фазы.
Увеличение активности родиевых катализаторов при добавлении малых количеств олова, по-видимому, обусловлено изменением размеров кристаллитов основного металла.
Библиографическая ссылка
Мусаев Д., Абдуалиева М.А., Абекова Ж.А., Оралбаев А.Б. КАТАЛИТИЧЕСКИЕ СВОЙСТВА МОНО- И БИМЕТАЛЛИЧЕСКИХ СИСТЕМ // Международный журнал прикладных и фундаментальных исследований. – 2015. – № 5-3. – С. 416-420;URL: https://applied-research.ru/ru/article/view?id=6800 (дата обращения: 18.04.2024).

