В основу классификации аденом гипофиза положены четыре основных принципа – размеры, направление и характер роста, гистологическое строение и гормональная активность. Современные аспекты классификации аденом претерпели некоторые изменения. В частности, аденомы гипофиза стали делить на микроаденомы (диаметр аденомы до 10 мм) и макроаденомы (диаметр более 10 мм). Некоторые авторы предлагают выделять аденомы среднего диаметра (10–20 мм) [12], и только опухоли более 20 мм относить к макроаденомам [8].
Среди всех опухолей гипофиза наиболее часто встречаемые – лактотропные аденомы – или пролактиномы, они составляют 29 % всех опухолей гипофиза, причем процент этот увеличивается до 47 %, есть учитывать не чистые пролактиномы, а их смешанный, полигормональный характер [8]. Важность выделения пролактином чрезвычайна, поскольку они могут влиять на репродуктивную функцию как у мужчин, так и у женщин, вызывая снижение потенции у первых и бесплодие у вторых. Эта важность возрастает не только с точки зрения эндокринологии, репродуктивной медицины и гинекологии, но и с позиций кардиологии и нейрохирургии. Так в последнее время появились работы, указывающие на взаимосвязь гиперпролактинемии и ожирения, а также некоторые пусковые механизмы гипертензии, активация которых происходит у больных с гиперпролактинемией через ренин-ангиотензин – альдостероновый механизм [6].
Магнитно-резонансная томография (МРТ) в настоящее время является основным методом в диагностике аденом гипофиза [2, 4, 8, 13].
Целью настоящего исследования было изучить возможности магнитно-резонансной томографии в диагностике пролактином и аденом гипофиза у больных артериальной гипертензией на этапах терапевтического и хирургического лечения, а также отработать оптимальные подходы и протоколы в проведении МРТ, её кратность в зависимости от размеров выявляемых образований.
Материал и методы. Исследование проводилось на низкопольном магнитно-резонансном томографе «Magnetom–Open» фирмы Siemens с напряженностью магнитного поля 0,2 Тл с использованием стандартных Т1-Т2 взвешенных изображений в трёх взаимно-перпендикулярных сечениях, с параметрами ТR (time repetition) = 340, TE (Time echo) = 26, количество срезов (№ Slices) = 7, толщина срезов (Slices Thickness) = 3мм; поле вида (Field-of view) – 230, матрица – 192×256, количество сборов данных (№ Acquisition) = 6. При наличии включений в гипофизе от 4 и более мм проводилось контрастирование омнисканом или магневистом в стандартных дозах.
Наш материал диагностических исследований МРТ гипофиза у больных c гиперпролактинемиями составляет 1200 больных (M-84, Ж-1116), которые проспективно наблюдались на протяжении от 1 года до 20 лет. У 30 % больных с гиперпролактинемией была АГ – 2–3 ст., примерно столько же больных (32 %) было с избыточной массой тела. У 46 % пациентов уровень пролактина в крови превышал норму в 2–3 раза, составляя в среднем более 1197,6 mlu/ml. В большинстве случаев, при превышении уровня пролактина 2500–3000 mlu/ml, имелись признаки микроаденомы или аденомы гипофиза. Группу сравнения составили лица, обследованные ранее на МР-томографе по другим основаниям. Как у здоровых, так и у больных с аденомами определялись размеры и объем гипофиза и аденом по методу Di-Chiero-Nelson [9] и собственному протоколу [5, 10], описанному нами ранее, при этом за нормальные значения размеров гипофиза принимались собственные значения и значения размеров и объема полученные другими авторами [3, 11,12].
Результаты исследований и их обсуждение. С позиций МРТ, данные пациенты были разделены на три группы: 1 группа – аденопатии гипофиза (n = 869, уровень пролактина 25–75 нг/мл), когда размер гипоинтенсивных включений в гипофизе не превышал 1–3 мм. При этом под аденопатиями понимается диапазон морфофункциональных изменений в гипофизе, который при определенных условиях, самостоятельно, или под влиянием лечения может при динамическом наблюдении, вернуться к норме. Вторая группа – микроаденомы гипофиза – размеры включения составляли от 4 до 6 мм (n = 202, пролактин 75–125 нг/мл); микроаденома лучше видна при контрастировании. Третья группа – аденомы гипофиза (n = 59, пролактин больше 125 нг/мл), размер которых был более 6 мм, но менее 10мм. Данный тип аденом особых затруднений в диагностике не вызывал, поскольку такой размер аденом позволял визуализировать их на МРТ томограммах во всех трех взаимно перпендикулярных сечениях, причем без применения контраста. Четвертая группа (n = 70), пролактин, превышал нормальные значения в 6–10 раз и более (4000–28000 мЕд/л) – макроаденомы гипофиза, размер которых составлял 11 мм и более.
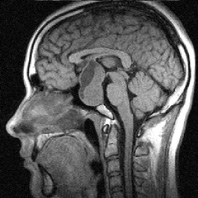
Диагноз микроаденомы гипофиза (диаметр менее от 4 до 6 мм) должен основываться, прежде всего, на клинических и эндокринных данных, а методы визуализации служат для подтверждения или исключения этой патологии. Вместе с тем, наш опыт показывает, что данный тезис не всегда является правомочным, поскольку встречаются так называемые гормонально неактивные аденомы, размер которых может значительно варьировать (рис. 1), а первые симптомы, обнаруживаемые у таких больных, возникают лишь при ограничении зрения или нарушения ликвородинамики.
Зачастую они составляют случайные находки, причем уже на стадии макроаденом. Так как размеры гормон секретирующей аденомы гипофиза могут составлять всего несколько миллиметров, то становится понятным требования к разрешающим системам томографов. Определение размеров аденомы чрезвычайно важно, в том числе и при проведении современных методов лечения, таких как, например, протонная терапия [7]. При подозрении на микроаденому наиболее предпочтительна толщина срезов – 3 мм. При такой толщине среза отношение сигнал /шум оптимально для диагностики на низкопольном томографе.
В процессе визуализации микроаденом следует принимать как прямые признаки опухоли, так и непрямые симптомы. К непрямым признакам аденомы можно отнести асимметричность опущения дна, смещение воронки гипофиза. При МРТ нормальная ткань аденогипофиза имеет гомогенный характер и изоинтенсивные характеристики с белым веществом мозга. При этом в норме, непосредственно у ножки гипофиза в центральной части могут определяться гипоинтенсивные на Т1 включения до 2–3 мм, которые по Алешину Б.В. представляют межтрабекулярные гранулы скопления коллоида [1]. Микроаденомы имеют увеличенные времена релаксации и проявляются на Т1 томограммах и выглядят как зоны с пониженным сигналом. Однако эти изменения могут быть слабо выраженные. По нашим данным чувствительность Т1 изображений выше чем Т2. Это объясняется близким расположением ликворных пространств, сигнал от которых также гиперинтенсивен в этом режиме. При наличии кровоизлияния в ткань опухоли наиболее патогмоничным является резкое повышение интенсивности сигнала на Т1 взвешенных изображениях.
При внутривенном введении контрастного вещества большинство микроаденом накапливает его, как и ткань аденогипофиза, однако заметно медленнее. Поэтому на постконтрастных срезах границы между опухолью и гипофизом могут стираться. В таких случаях становится эффективным болюсное динамическое сканирование, позволяющее более точно дифференцировать аденому. При наличии МР-картины микроаденомы следует всегда учитывать данные анамнеза, клиники и эндокринологических анализов.
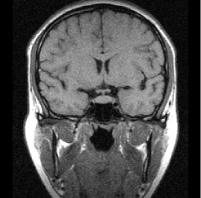
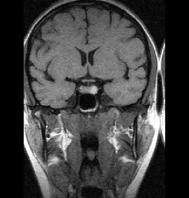
а б
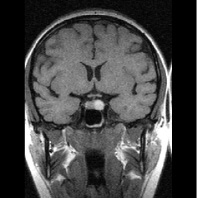
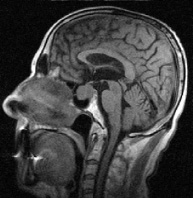
в г
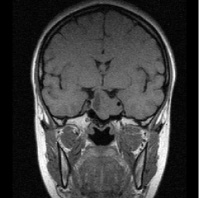
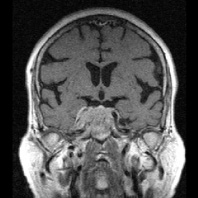
Рис. 1. Примеры томограмм согласно предлагаемой классификации с точки зрения новых подходов в лучевой диагностике: а – аденопатия гипофиза размеры гипоинтенсивных включении 1–3 мм; б – микроаденома 4–6 мм; в – аденома – 10 мм; г – макроаденома – аденома более 10 мм с инфраселлярным ростом
Большинство макроаденом имеют изо- или гипоинтенсивный сигнал на Т1 взвешенных изображениях и слабогиперинтенсивный на Т2. Структура гетерогенна. В некоторых случаях на основании картины МРТ можно предполагать смешанный тип строения аденомы. Наиболее часто это касается соматотропином, когда наряду с повышенным пролактином в крови, наблюдаются признаки гиперостоза костей свода черепа, хорошо видимые на томограммах. В типичных случаях МРТ выявляет объемный процесс, исходящий из турецкого седла, изо- или гипоинтенсивный на Т1 взвешенных изображениях, сдавливающий нормальную гипофизарную ткань, сигнал от которой более интенсивен. По характеру роста макроаденомы распределялись согласно принятым классификациям – эндоселлярным (мезоаденомы), супраселлярным, инфраселлярным и латероселлярным ростом с охватом сифонов внутренних сонных артерий (рис. 2). В трех случаях наблюдался стебельный рост по скату, а аденома гипофиза сочеталась с менингиомой. На томограммах при макроаденомах чаще сам гипофиз выделить практически не удается.
Несмотря на латероселлярный рост и большое количество наблюдений макроаденом сдавление сифона внутренних сонных артерий встречается редко. В нашем исследовании из 70 макроаденом гипофиза сдавление сифона ВСА мы отмечали лишь в 4 случаях (3 %), что не противоречит данным других авторов. Примерно, 70 % больных с макроаденомами, в силу инфраселлярного роста (рис. 2 а, б, г) были прооперированы трансназально-трансфеноидальным доступом, экстраселлярный рост и макроаденомы больших размеров оперировались транскраниально с использованием передней лоботомии. У двух пациентов с аденомами смешанного строения небольших размеров (6 и 8 мм) была проведена успешная протонная терапия (на базе НИИ рентгенорадиологии г. Санкт-Петербурга).
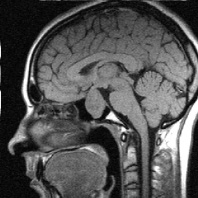
Больные с аденомами после операции, попадали на контроль спустя 3–6 месяцев. При проведении низкопольной томографии в раннем послеоперационном периоде имелись трудности в интерпретации селлярной области. Обусловлено это тем, что в раннем послеоперационном периоде (от 1 до 3-х месяцев), ещё может сохраняться отек мягких тканей и реакция со стороны основной пазухи. Выделить в этих условиях переднезадний размер после тампонады клиновидной пазухи и высоту остатков гипофизарной ткани бывает не просто даже при контрастировании (рис. 3).
Повторные исследования у оперированных больных следует проводить с учетом гистологического строения ткани. При гормонально неактивных аденомах достаточно наблюдения одного раза в год, при гормонально активных – 1 раз в 6 месяцев, при отсутствии каких-либо других клинических показаний. В случаях контроля за пациентами с аденомами гипофиза, получающими терапию ингибиторами пролактина, контроль МРТ гипофиза следует проводить один раз в год, поскольку регресс морфологических изменений заметно отстает от биохимических маркеров.
а б
в г
Рис. 2. Типы роста макроаденом: a – в форме песочных часов (соматопролактинома); б – левосторонний латеро-инфраселлярный с охватом сифона ВСА слева; в – стебельный рост аденомы в сочетании с менингиомой стелящегося типа; г – преимущественно инфраселлярный
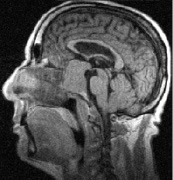
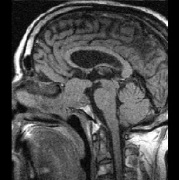
а б
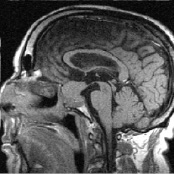
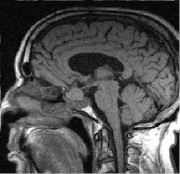
в г
Рис. 3. Томограмма больного К, 62 г. от 19.09.2008 г.: а – выявлена макроаденома объёмом 21,6 куб. см с инфра-, эндо-, супраселлярным ростом; б – томограмма от 02.02.2009 г., выполнена спустя 5 мес после оперативного лечения
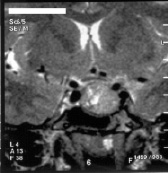
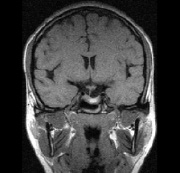
a б
Рис. 4. a – аксиальное (1999 г., ПРЛ – 10000ммЕ/л); б – фронтальное сечения больной Я, 38 лет, выполненное с интервалом в 3 года (2001 г., ПРЛ – 294 ммЕ/л): a – 1999 г., б – 2001 г. Исходно пролактин – 10000 ммЕ/л, через три года – 294 ммЕ/л. Терапия бромокриптин 5 мг в неделю, беллоид 1 т×2 рд двухнедельными курсами, йодомарин 100 мг ежедневно. Исходно размеры 21×20×19 мм; через три года – 20×10×14 мм. Хиазма свободно расположена, центрально прослеживается участок кровоизлияния, подвергающийся резорбции
Рецидивы аденом после оперативного вмешательства (в наших случаях за период наблюдения их было 13, причем 1 пациент – был оперирован 4 раза, четверо – трижды, – 8 пациентов – дважды, процент рецидива составил – 9,3 %), требуют особого подхода в связи с определенными отягощающими обстоятельствами. Наряду со случаями успешного хирургического лечения больных с макроаденомами, следует привести и примеры успешного консервативного ведения пациентов с аденомами гипофиза, даже макроаденомами, когда их размер составлял более 20 мм (4 – наблюдения). Все эти случаи касались пролактином, (рис. 4). Пример, одного из таких наблюдений приводится ниже.
Выводы
Эти случаи подтверждают тот факт, что при пролактиномах ведение пациентов консервативным способом вполне оправдано. Регресс клинической симптоматики особенно выражен при микроаденомах гипофиза, связанных дисфункцией щитовидной железы, приёмом контрацептивных средств, а также при микропролактиномах (размер гипоинтенсивных включений в передней доле 4–6 мм), аденомах, размеры которых не превышали 10мм. Именно, исходя из этих соображений, при динамическом МРТ наблюдении, патологические изменения в передней доле гипофиза мы разделили на аденопатии (мелкие гипоинтенсивные на Т1 включения до 1–2 мм в передней доле гипофиза числом от 1 до 4-х, не склонные к слиянию), микроаденомы – размеры 4–6 мм и аденомы (6–10 мм), и макроаденомы – размеры аденом были более 10 мм. В большинстве эти случаи требуют консервативной тактики лечения у эндокринолога, но подход с точки зрения МРТ – наблюдения должен быть разный. Так, при изменениях гипофиза, обусловленных аденопатиями достаточно наблюдения 1 раза в 2 года; при аденомах, размер которых составляет 4–6 мм – 1 раз в 1,5 года; при пролактиномах размером 6–10 мм – 1 раз в год. Следует отметить, что в процессе динамического наблюдения за больными с аденомами гипофиза при гиперпролактинемиях, следует добиваться перевода аденомы в аденопатию, а при уменьшении размеров включений до 2–3 мм, обязательно должен осуществляться в дальнейшем гормональный контроль раз в 3–6 мес. При этом, нет необходимости, как понимают некоторые эндокринологи в проведении магнитно-резонансной томографии на этапах лечение бромокриптином или достинексом каждые полгода. Оптимальным можно считать, когда контроль над ситуацией ведется в содружестве врача – эндокринолога и специалиста МРТ.
Библиографическая ссылка
Лукьянёнок П.И., Усов В.Ю., Ворожцова И.Н., Цыров Г.И., Гудкова Т.Н. МАГНИТНО-РЕЗОНАНСНАЯ ТОМОГРАФИЯ ПРИ АДЕНОМАХ ГИПОФИЗА. ДИНАМИМЕСКОЕ НАБЛЮДЕНИЕ И КОНТРОЛЬ ЛЕЧЕНИЯ // Международный журнал прикладных и фундаментальных исследований. – 2016. – № 2-3. – С. 402-407;URL: https://applied-research.ru/ru/article/view?id=8490 (дата обращения: 19.04.2024).

