В условиях патологии проявляются специфические изменения в физико-химическом составе и морфологической картине фации слюны. Участие слюны в процессах минерализации, деминерализации и реминерализации в ротовой полости при патологическом процессе ослабляется [1], угнетается защитная функция слюны в антимикробном, иммунологическом, механическом и химическом очищении. Теряется четкость геометрических форм кристаллов солей центральной зоны, а при усугублении патологии – полностью утрачивается [6]. Очевидно, при контакте ротовой биожидкости со злокачественным новообразованием слизистой полости рта опухоль вносит не только метаболическую, но и чужеродную волновую информацию, нарушающую собственные ауторитмы молекул и надмолекулярных структур, искажающие нормотипы самоорганизации фаций слюны. Возникающая конкуренция между физиологическими молекулярными структурами и патологическим субстратом отражается в детерминантном влиянии последних на процессы структуропостроения [2]. Установлено, что метод химио лучевой терапии, модифицированной ультразвуком, у больных местно-распространенным раком слизистой полости рта (РСПР), позволяет добиться получения более высокого противоопухолевого эффекта, за счет увеличения биодоступности химиопрепаратов к опухоли [10]. Таким образом, целью исследования явилось анализ морфологической структуры твердотельных фаций ротовой жидкости (слюны) у больных местно-распространенным раком слизистой полости рта (РСПР) при лучевой терапии с включением модифицированной ультразвуком локальной химиотерапии.
Материалы и методы исследования
Пациенты местно-распространенным РСПР Т2-4N0-2M0 были разделены в зависимости от варианта лечения на основную (31 больных) и контрольную (30 больных) группы. По возрасту и основным клиническим параметрам группы были сопоставимы. Больным обеих групп проводилась ДГТ с традиционно расщепленным курсом: разовая очаговая доза (РОД) в 2,4 Гр по 1,2 Гр с интервалом между ними 5 часов. Пациентам основной группы при ДГТ в середине интервала между отдельными фракциями РОД на первичный очаг опухоли через день осуществлялась локальная сонодинамическая химиотерапия (СДХ) с использованием среднечастотного УЗВ (частота 0,88 МГц, I = 0,4-1,0 Вm/см2, время экспозиции 5-10 мин) с 5 мг сухого платидиама, смешанного «ex tempore» с 0,25 см3 стоматологического солкосерил геля. На первичный очаг на 1 этапе подводилась суммарная очаговая доза 40 изоГр. Больным контрольной группы химиотерапия проводилась без УЗВ. Противоопухолевый эффект оценивали по клиническому состоянию опухоли.
Исследования морфологической структуры биожидкости ротовой полости были проведены у всех больных до начала противоопухолевой терапии и после получения клинического результата. Для изучения морфологической структуры ротовой биожидкости у всех больных утром натощак, через 15–20 минут после предварительного полоскания полости рта кипяченой водой, собирали слюну. Полученную биожидкость исследовали по методике клиновидной дегидратации Шабалина-Шатохиной [3,6,7]: каплю слюны в количестве 15–20 мкл в нативном виде наносили на покровные стекла и высушивали при температуре 18–22ºС в течение 18–24 часов. В процессе высыхания предметное стекло оставалось неподвижно в строго горизонтальном положении и полном отсутствии движения окружающего воздуха. Микроскопирование структур твердотельных пленок слюны проводили в проходящем, поляризованном свете и темном поле с помощью микроскопа «Zeica» DMLS2 с увеличением от х10 до х90.
Результаты исследования и их обсуждение
При изучении текстуры фаций ротовой биожидкости до начала лечения в 100 % случаев установлено нарушение нормотипа структуропостроения (рисунок, а).
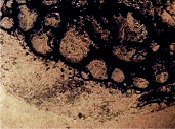

а б

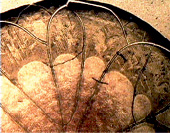
в г
Фрагменты фаций слюны у больных РСПР: а. Рост опухоли до лечения. Белковые конгромераты в центральной зоне фации. б. Рост опухоли на фоне противоопухолевой терапии. Аморфный тип фации. в. Частичная регрессия опухоли. Формирование фации с системныой радиальных трещин. г. Регрессия опухоли. Образование аркадных трещин, в краевой зоне отдельностей формирование внутрифрактальных волн. Увеличение х20, х90
Краевая зона, как правило, была аморфизирована или с небольшим количеством хаотически расположенных тонких коротких трещин. В центральной зоне отмечалось резкое угнетение кристаллизации солей. Единичные кристаллы полностью утрачивали дендритную форму, имели линейный характер роста с образованием ветвей первого порядка. При краевой дегидратации выявлялись маркеры деструкции, которые представляли собой кристаллы высвобожденного холестерина. В отдельных фациях наблюдалось формирование наслаивающихся друг на друга ступенчатых прямоугольных пластин неправильной формы.
Иными словами, избыток патогенных продуктов, главным образом воспалительных и токсических белков, а также холестерина, обуславливал сбой процессов самоорганизации, что выражалось нарушением ауторитмов кристаллизации белков и солей. Неравномерность слоев белка, отсутствие системы трещин краевой зоны, появление маркеров некробиотических и деструктивных изменений отражали картину патоморфологических изменений слюны как непосредственной среды окружения злокачественного новообразования полости рта.
У больных при неэффективном лечении, когда, несмотря на лечебные воздействия, не удавалось сдерживать рост опухоли, краевая зона, как правило, была аморфизирована или с небольшим количеством хаотически расположенных тонких коротких трещин (рисунок, б). В центральной зоне отмечалось резкое угнетение кристаллизации солей Единичные кристаллы полностью утрачивали дендритную форму, имели линейный характер роста с образованием ветвей первого порядка. При краевой дегидратации выявлялись маркеры деструкции, которые представляли собой кристаллы высвобожденного холестерина. В отдельных фациях наблюдалось формирование наслаивающихся друг на друга ступенчатых прямоугольных пластин неправильной формы. В промежуточной зоне наблюдались множественные пластинчатые структуры, относящиеся к аллотропной форме типа «стекол». О подобных находках в дегидратированных каплях водно-белковой системы сообщалось в работах Рапис Е.Г. [5], которая указывала на самосборку белка в виде многомерной агрегации коллоидов с переходом в «застекленную» фазу. Было отмечено также появление множества мелких белковых агрегаций в виде спирально скрученных пленок, между которыми определялись трубчатые структуры с различными цветовыми оттенками. Визуализация трубок голубого оттенка свидетельствовала о наличии в жидкой среде индиканов, активированных ферментами с образованием индиго.
Однако наиболее важным отличительным признаком в структуре фации слюны у больных с неэффективным лечением и продолженным ростом опухоли слизистой полости рта стало включение мелких анизотропных кристаллов белка звездчатой формы с аномальным лучевым ростом. В поле зрения можно было видеть несколько десятков светящихся в поляризованном свете кристаллов, характеризующих атипию развития морфотипа фации слюны.
Подобные структуры отмечались при краевой дегидратации сыворотки крови у больных раком других локализаций [4, 8, 9]. Помимо этого, аномальные кристаллы могут быть связаны с насыщением биожидкости смесью фосфолипидов с холестерином, эфиры которого обладают высокой поляризацией, а также накоплением в среде патологических фракций типа ά2-макроглобулина, ß1-липопротеида, фибриногена, ß2- и γ-глобулина. Клинически такие признаки фаций слюны давали оценку не только онкологическому процессу, но и атеросклеротическим повреждениям, нарушениям функции печени и другой патологии [2, 3, 6].
В случаях, когда при проведении комплексного лечения, включающего лекарственное, лучевое и локальное химиотерапевтическое воздействие с использованием ультразвука, наступала частичная регрессия опухоли (уменьшение объема более чем на 50 %), кристаллографическая картина слюны больных раком слизистой ротовой полости значительно менялась. Были выделены позитивные признаки самоорганизации солей в центральной зоне с преобладанием кристаллов крупных и средних размеров. Несмотря на доминирование линейного роста с ветвями I порядка, на препаратах фаций слюны выявлялись централизованные монокристаллы с ветвями II порядка. Безусловно, эффективное лечебное воздействия на опухоль сопровождалось побочными процессами накопления продуктов распада опухоли. Это обстоятельство подтверждалось выявлением значительных скоплений детрита, патогенных белков, пигментов, токсинов на поверхности кристаллов солей в центральной зоне фации слюны, их биоминерализации. Мелкие и крупные глыбки патогенных включений распространялись по всей поверхности фации, вплоть до краевой зоны. Постепенно по мере активации процессов биоминерализации и повышения локального иммунитета на фоне подавления роста опухоли наблюдалось очищение слюны от патогенных включений и структурирование краевой зоны (рисунок, в).
Появление в краевой зоне фаций маркеров интоксикации (морщины белка) указывали на увеличение поглощения химиопрепаратов в опухолевую ткань ротовой полости и частичную реализацию противоопухолевого эффекта. Спустя сутки в фациях слюны эти маркеры уже не обнаруживались, и краевая зона представлялась аморфной или плотной сетчатой структурой трещин. Отмечалось формирование цветных трубок малинового оттенка (продукты незавершенного метаболизма, химиопрепараты), которые образовывали с нитями псевдомицелия грибов Candida своеобразный структурный «симбиоз».
Иными словами, при более эффективном лечении рака слизистой полости рта под влиянием химиолучевой терапии с включением локальных воздействий лекарственного препарата и ультразвука наблюдалась сложная надмолекулярная перестройка компонентов окружающей опухоль биожидкости. Она характеризовалась, с одной стороны, заметным упорядочиванием белково-солевых соотношений самой биожидкости с восстановлением зонального расположения кристаллизации солей и роста ветвей I и II порядка, обеспечивающих активизацию биоминерализации, как эффективного механизма обезвреживания влияния патогенных продуктов метаболизма. С другой стороны, фиксировалось усиление попадания в окружающую среду регрессирующей опухоли элементов некротических и деструктивных процессов, сопровождающих рассасывание опухолевого очага. Это было наглядно продемонстрировано образованием в фациях слюны «капсул» с оптически плотными белковыми конгломератами округлой и трубчатой формы.
В целом, фации слюны у больных с частичной регрессией опухоли РСПР отличались положительной динамикой самоорганизации и отражали участие биожидкости в повышении противоопухолевой резистентности организма-опухоленосителя путем активации процессов биоминерализации и выведения продуктов распада опухоли.
В случаях, когда удавалось достичь полной регрессии опухоли у больных местно-распространенным РСПР, морфоструктура фаций ротовой жидкости отражала более активную динамику процессов взаимодействия защитных механизмов биоминерализации, агрегации патогенных биокомплексов невысокой оптической плотности. Особенное внимание обращало структурное обеспечение «барьерной» функции краевой зоны, в которой концентрация патогенных конгломератов значительно снижалась. Наблюдалось растрескивание белковой основы фации и образование коротких и тонких межгранульных трещин, заполненных детритом низкой оптической плотности.
Во всех случаях эффективного лечения четко прослеживалась солевая кристаллизация в расширенной центральной зоне, заполнение промежуточной зоны мелкими белковыми гранулами, а также четкое структурирование краевой зоны с тенденцией формирования нормотипа с системой радиально-аркадных трещин (рисунок, г).
Во всех фациях был сформирован активный солевой центр с кристаллами, имеющими ветвления I и II порядка, что обеспечивало интенсивную биоминерализацию патологических веществ (токсических белков, некротических масс, продуктов незавершенного метаболизма) и очищение биожидкости. В краевой зоне фации, в отдельных случаях была визуализирована конгломерация и организация мелких гранул патогенных веществ в розеткоподобные структуры. При большом увеличении в полях зрения можно было видеть участки очищенной закристаллизованной ротовой жидкости с единичными трубчатыми структурами розового и желтого оттенков с линейной и спиральной симметрией.
В таблице представлена морфологическая классификация слюны больных РСПР в зависимости от эффективности противоопухолевой терапии.
Морфологическая классификация слюны у больных раком слизистой полости рта в зависимости от эффекта лечения
|
Эффект лечения |
Отличительные признаки |
||
|
Краевая зона |
Промежуточная зона |
Центральная зона |
|
|
Полная резорбция опухоли 100 % |
Расширена, четкие границы, в 2-3 раза уже промежуточной, тенденция к восстановлению радиально-аркадных трещин, наличие редких розеткоподобных гранул с малой оптической плотностью. |
Наличие прерывистых круговых концентрационных волн, без выраженного роста кристаллов, фолдинг патогенных белков с цветными включениями. Споры и нити псевдомицелия кандид. |
Рост кристаллов солей линейной структуры с короткими ветвями II порядка, выражены процессы биоминерализации. |
|
Частичная регрессия опухоли ≥ 50 % |
Расширение зоны, плотная сетчатая структура трещин, крупная у края, скопление оптически плотных гранул |
Развитие сети мелких трещин, наличие включений, формирование белковых трубок различной цветовой гаммы. |
Рост кристаллов линейной структуры с ветвями II порядка. Оплавление части белковыми соединениями с пигментацией. Выраженная биоминерализация. |
|
Прогрессия опухоли ˂ 25 % |
Аморфизация зоны, многочисленные пигментированные включения жидкокристаллические структуры. |
Появление множества мелких кристаллов с анизотропными свойствами и жидкокристаллических структур с цветным оттенком. |
Аморфизация зоны, обилие округлых белковых структур, опоясанных широкими трещинами с заполнением пигментированных включений. |
Таким образом, морфологическое исследование ротовой жидкости при переходе в твердотельную фазу демонстрировало различный уровень самоорганизации биосреды в зависимости от состояния опухоли у больных местно-распространенным раком слизистой полости рта (таблица), что может быть использовано для прогноза эффективности противоопухолевого лечения.
Это выражалось в подавлении структурообразования основных признаков системного уровня (отсутствие солевого центра, аморфизация, аномалия краевой зоны) при росте злокачественной опухоли ротовой полости. Напротив, отмечена тенденция восстановления нормотипа фации слюны при частичной регрессии и выраженная нормализация структурного рисунка фации при полной резорбции опухоли. Об этом свидетельствовали дендритные формы кристаллизации солей и процессы активной биоминерализации, снижение протеинонемии и связанного с ней фолдинга патогенных белков в виде локальных закристаллизованных надмолекулярных дефектных структур. Очищение биожидкости полости рта от токсинов и патогенных веществ способствовало структуризации краевой зоны и появлению системы радиальных трещин, как критерия повышения самоорганизации слюны при переходе в твердую фазу. Простота, доступность и информативность исследования морфоструктуры слюны, позволяет использовать, полученные критерии для оценки эффективности противоопухолевой терапии.
Библиографическая ссылка
Шихлярова А.И., Шейко Е.А., Комарова Е.Ф., Протасова Т.П., Куркина Т.А., Розенко Л.Я., Гусарева М.А., Крохмаль Ю.Ю., Франциянц Е.М., Бартеньева Т.А. ОСОБЕННОСТИ КРИСТАЛЛИЗАЦИИ СЛЮНЫ У БОЛЬНЫХ С МЕСТНО-РАСПРОСТРАНЕННЫМ РАКОМ СЛИЗИСТОЙ ПОЛОСТИ РТА КАК КРИТЕРИЙ ЭФФЕКТИВНОСТИ ПРОТИВООПУХОЛЕВОЙ ТЕРАПИИ, МОДИФИЦИРОВАННОЙ УЛЬТРАЗВУКОМ // Международный журнал прикладных и фундаментальных исследований. – 2016. – № 5-4. – С. 584-588;URL: https://applied-research.ru/ru/article/view?id=9455 (дата обращения: 18.04.2024).

