За все время своего существования человечество, по причине естественного мутационного процесса, накопило генетический груз, который проявляется во всевозможных наследственных генетических заболеваниях. Какое число мутаций накопило человечество, какой генетический груз мы получили в наследство от наших предков, такое здоровье и будет у нас и всех последующих поколений.
Старение организма связано с постепенным накоплением ошибок ДНК, возникающих в связи с разрывом цепей, с ошибками репарации ДНК. Поэтому, логично рассмотреть факторы, которые неблагоприятно воздействуют на ДНК. Считается, что самым распространенным мутагеном, повреждающим ДНК является солнечная радиация, в частности, ультрафиолетовое излучение. Из года в год ультрафиолетовое излучение становится более агрессивным и оказывает все большее влияние на геном человека, и организм в целом, вызывая рак кожи, меланому кожи, её преждевременное старение, ожог роговицы глаза и так далее [3]. Именно поэтому исследования в области снижения влияния ультрафиолетового излучения на ДНК особенно актуальны в наше время.
На ДНК так же отрицательно воздействует и «тяжелая» вода (D2O, оксид дейтерия). Внедряясь в структуру ДНК и различных РНК, дейтерий может явиться причиной рекомбинаций. Известны, по крайней мере, две различные реакции такого рода: разрывы нитей ДНК и потери участков ДНК. Установлено, что облегченная вода при индукции апоптоза активирует репаративные системы ДНК [9].
В условиях модели окислительного стресса на животных было установлено влияние низких концентраций дейтерия воды на показатели антиоксидантной защиты организма [1, 2]. Также показано, что потребление воды с пониженным содержанием дейтерия способствует уменьшению его концентрации в биологических жидкостях [4, 6]. Экспериментально показано, что при введении воды с пониженным содержанием дейтерия в питьевой рацион лабораторных животных наблюдается увеличение массы тела крыс и происходит коррекция метаболических процессов [7]. Доказано влияние изотопного состава среды на концентрацию клеточной биомассы Rhodococcus erythropolis (нефтеокисляющей актинобактерии), а именно, при инокуляции клетками актинобактерии Rhodococcus erythropolis, которых вырастили на среде с содержанием дейтерия 71 и 98 ppm, просматривалось внушительное увеличение клеточной биомассы по сравнению с контрольными образцами [8].
Таким образом, целью работы являлось исследование возможности восстановления однонитевых разрывов ДНК после облучения ультрафиолетовым излучением с помощью модификации изотопного (D/H) состава среды.
Материалы и методы исследования
В ходе эксперимента кровь животных (крыс) разделили на 3 группы:
группа 1 – инкубирование лимфоцитов животных проводили в физиологическом растворе (150 ± 2 ppm) при комнатной температуре;
группа 2 – инкубирование лимфоцитов животных проводили в физиологическом растворе на воде с пониженным содержанием дейтерия (50 ± 2 ppm) при комнатной температуре;
группа 3 – инкубирование лимфоцитов животных проводили в физиологическом растворе на воде пониженным содержанием дейтерия (40 ± 2 ppm) при комнатной температуре.
Выделение лимфоцитов для всех групп проводили по следующей методике. В пробирки с кровью добавили физиологический раствор, в количестве равном объему крови, содержащейся в них. Далее вносили в новые пробирки А (эппендорфы) фиколл-урографин в объеме 0,5 мл и методом наслоения в каждую пробирку добавляли 0,5 мл крови. Пробирки А центрифугировали 20 минут при 4000 об/мин, затем, образовавшееся в центральной части пробирок кольцо мононуклеарных клеток переносили в пробирки Б.
Следующим шагом было внесение в пробирки Б физиологического раствора для всех групп в объеме, равному 1 мл. Пробирки Б центрифугировали 10 мин при 4000 об/мин. Удалив надосадочную жидкость, внесли в пробирки Б физиологический раствор в объеме 0,5 мл. Далее, на Вортексе интенсивно встряхивали пробирки 3-5 секунд. После еще одного центрифугирования (10 минут на 4000 об/мин), удалили надосадочную жидкость. После этого полученные лимфоциты троекратно отмывались в физиологическом растворе.
Следующим этапом в работе было воздействие на выделенные лимфоциты УФ излучением. Для обработки образцов использовали ртутную дуговую лампу типа ДРЛ 125 – газоразрядная ртутная лампа высокого давления, мощностью 125 В, длиной волны 280 – 400 нм и световым потоком 5900 лм, без внешней колбы с люминофором. Таким образом, в световом потоке присутствовало только ультрафиолетовое излучение.
Обработку УФ излучением производили следующим образом: часть образцов из каждой группы находились под воздействием ультрафиолетового излучения 30 минут, еще одна часть образцов подвергалась воздействию 1 час.
Далее, лимфоциты инкубировались в физиологическом растворе (150 ± 5 ppm) для группы № 1, в физиологическом растворе на воде с пониженным содержанием дейтерия (50 ± 2 ppm) для группы № 2 и в физиологическом растворе на воде пониженным содержанием дейтерия (40 ± 2 ppm) для группы № 3 при комнатной температуре в течении 24 часов. После этого клетки лизировали 4,5 М раствором мочевины в течение 10 мин при температуре 24 °С. Лизаты клеток в экспериментальных образцах подвергали щелочной обработке в течение 30 мин при 0 °С, а затем подвергали интенсивному встряхиванию на Вортексе в течение 15 с. Контрольные образцы щелочной обработке не подвергали и использовали для определения фоновой флюоресценции. После этого во все образцы добавляли раствор бромистого этидия.
После щелочной обработки лизатов и добавления бромистого этидия измеряли интенсивность флюоресценции полученных образцов в кварцевой кювете на флуоресцентном спектрофлуориметре Hitachi F-2700 при λогл = 610 ± 5 нм под прямым углом к направлению возбуждающего света [9].
Определение концентрации дейтерия в жидких средах проводили на импульсном ЯМР спектрометре JEOL JNM-ECA 400 MHz по методике, описанной в [5].
Результаты исследования и их обсуждение
При воздействии УФ-излучения до 80 % повреждений ДНК в живых клетках индуцируется именно синглетным кислородом. С учётом того факта, что примерно 30 % повреждений ДНК, индуцированных синглетным кислородом, представляют собой щелочнолабильные сайты, а ещё 2 – 5 % однонитевые разрывы можно заключить, что при воздействии УФ излучения синглетный кислород является не менее важным источником однонитевых разрывов и щелочнолабильных сайтов ДНК, чем гидроксил радикал.
Число однонитевых разрывов ДНК оценивали по соотношению величин флуоресценции экспериментальных и контрольных образцов. Результаты представляли в виде процентного соотношения количества щелочнолабильных сайтов ДНК, содержащих однонитевые разрывы к общему количеству ДНК. Воду с пониженным содержанием дейтерия производили на разработанной в Кубанском государственном университете установке ЛВ-1 [10].
Полученные данные анализировали в пакете статистического анализа Statistica 6.0. Сравнение групп по количественным признакам проводили с использованием двухвыборочного t-критерия Стьюдента. Различия считали статистически значимыми при р < 0,05.
На рис. 1 представлена интенсивность флуоресценции растворов без УФ облучения.
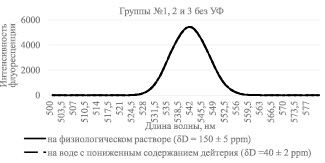
Рис. 1. Интенсивность флуоресценции раствора бромистого этидия с лизатами лимфоцитов, инкубируемых в среде с различным содержанием дейтерия, без УФ облучения образцов
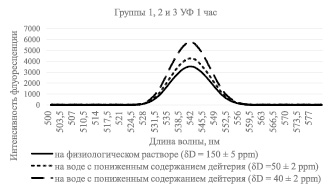
Рис. 2. Интенсивность флуоресценции раствора бромистого этидия с лизатами лимфоцитов, инкубируемых в среде с различным содержанием дейтерия, с УФ облучением образцов по времени, равному 1 час
Как видно из рис. 2, интенсивность свечения раствора лимфоцитов, проинкубированных в обедненной дейтерием воде c 50 и 40 ppm, при облучении УФ, равному 1 час, больше, чем у раствора лимфоцитов проинкубированных в обычной воде (150 ppm), что свидетельствует об уменьшении количества однонитевых разрывов при инкубации лимфоцитов в обедненной дейтерием воде, причем вне зависимости от времени, проведенного под воздействием УФ облучения. Аналогичную картину мы наблюдаем на рис. 3, где образцы были проикубированы в обедненной дейтерием воде с концентрацией 50 и 40 ppm при облучении образцов, равному по времени 30 минут.
На рис. 4 представлено процентное соотношение однонитевых разрывов при различных содержаниях дейтерия в растворе и разном времени обработки образцов УФ излучением.
Как видно из полученных результатов, количество однонитевых разрывов меньше в образцах, проинкубированных в среде с пониженным содержанием дейтерия 50 ppm и 40 ppm. Как следствие, можно утверждать, что вода с пониженным содержанием дейтерия оказывает положительное влияние на сохранность ДНК, кроме того, это явление не зависит от продолжительности облучение УФ образцов.
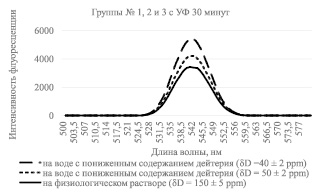
Рис. 3. Интенсивность флуоресценции раствора бромистого этидия с лизатами лимфоцитов, инкубируемых в среде с различным содержанием дейтерия, с УФ облучением образцов по времени, равному 30 минутам
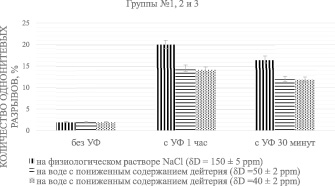
Рис. 4. Влияние обедненной по дейтерию воды на количество однонитевых разрывов в отсутствии и УФ облучении
Заключение
Следует учитывать, что клетки организма постоянно подвергаются воздействию множества генотоксических факторов как экзогенного, так и эндогенного происхождения и поэтому, эффективная работа систем сохранения и репарации ДНК является важным условием для их нормальной жизнедеятельности. Полученные результаты дают возможность предположить, что вода с низким содержанием дейтерия (50 и 40 ppm) действительно приводит к уменьшению однонитевых разрывов и как следствие, к снижению вероятности мутаций клеток организма.
Библиографическая ссылка
Елкина А.А., Шашков Д.И., Барышева Е.В. ВЛИЯНИЕ СРЕДЫ С МОДИФИЦИРОВАННЫМ ИЗОТОПНЫМ D/H СОСТАВОМ НА РЕПАРАЦИЮ ДНК ЛИМФОЦИТОВ ПОСЛЕ УФ ОБЛУЧЕНИЯ // Международный журнал прикладных и фундаментальных исследований. – 2016. – № 8-4. – С. 557-561;URL: https://applied-research.ru/ru/article/view?id=10124 (дата обращения: 20.04.2024).

