Ранее А.М. Кузиным с соавт. был обнаружен феномен вторичного биогенного излучения (ВБИ), который проявлялся после γ-облучения различных биологических объектов (индукторов) в дозах, не приводящих к ингибированию их развития [11-13]. На высших растениях и животных использовалось радиационное воздействие γ-облучения в различных малых дозах (от десятков сГр до 10 Гр и более) в зависимости от чувствительности объекта. При этом такие обработанные γ-радиацией биообъекты приобретали свойство, которое ранее не наблюдали в радиобиологических исследованиях – дистанционно, в течение нескольких часов генерировать митогенетическое излучение, способствующее делению клеток, росту и развитию живых организмов [15, 26]. Это излучение было названо ВБИ. При дальнейших исследованиях открытого феномена [16, 18] было найдено, что под влиянием ВБИ происходит значительное увеличение всхожести старых семян, а также «оживление» старых летальных дрожжевых клеток, почти полностью утративших свойство прорастать на полноценной питательной среде. Летальный исход организма (клетки) определяется рецессивными и доминантными летальными генами. При этом рецессивные летальные гены действуют в гомозиготном состоянии, а доминантные гены – в гетерозиготном. Но существует и другой механизм, когда летальные гены в гетерозиготе способны к образованию жизнеспособных клеток. Такой механизм сохранения жизнеспособности называют сбалансированной летальностью, мы полагаем, что он проявлялся в наших опытах с дрожжами. В этих опытах летальные клетки образовались в результате сложных физиологических изменений в процессе глубокого старения, и лишь только ВБИ было способно их «оживить». Было найдено, что источником ВБИ могут быть живые ткани, молекулы нативной ДНК и белки при их γ-облучении [17, 19].
Ранее нами было показано, что ВБИ излучения семян, облученных γ-излучением в дозе 7,5-10 Гр при мощности дозы 0,18 Гр/мин достоверно увеличивало количество нормальных колоний дрожжей Sporobolomyces alborubescens Derx в 2-3 раза [18]. На семенах томатов, подвергнутых 6-летнему космическому полету [22], нами было показано «оживляющее» митогенное действие ВБИ культуры баллистоспоровых дрожжей Sporobolomyces alborubescens Derx, облученной сверхнизкими дозами γ-излучения, сравнимого по интенсивности с природным радиационным фоном (ПРФ): всхожесть семян увеличивалась почти на 50 %, выявлялись условно-летальные мутации при оптимальной дозе 1,2.10-4 сГр. Целью настоящей работы является исследование влияния излучения ВБИ, индуцированного различными сверхнизкими дозами ПРФ (1•10-6, 6•10-6 и 1,2•10-4 сГр) и γ-излучения (1,2•10-3, 1,2•10-2 и 1,2•10-1 сГр) в монослое клеток дрожжей этого вида, на выживаемость нормальных и мутантных летальных клеток старой культуры исследуемых дрожжей. Были поставлены следующие задачи:
1) выявить зависимость доза-эффект по этим показателям;
2) рассмотреть возможные молекулярные и клеточные механизмы действия ВБИ и других видов слабых и сверхслабых излучений – биогенных излучений (БИ) клеток живых организмов и излучения ПРФ;
3) привести возможные механизмы увеличения эффективности действия на биологические объекты ВБИ, в том числе при его поляризации за счет воздействия света определенной частоты и поляризованной составляющей реликтового излучения (РИ), являющегося одним из компонентов ПРФ [5].
Материалы и методы исследования
Установка для облучения
В экспериментах использовали γ-источник 137Сs (установка типа Ц1-6) с активностью 1,5 108 Бк = 1,5 Гр. Установка находилась в свинцовом контейнере-коллиматоре в помещении с размерами 2х2х2 м. В рабочем режиме установки создавался конус облучаемого пространства над поверхностью стола с углом около 90 °. Конус имел различную высоту над поверхностью стола для получения различной дозы облучения. Измерение мощности дозы в опытных точках на столе, в которых размещались чашки Петри с культурой дрожжей Spоrоbоlоmусеs аlborubescens Derx., проводили с помощью сцинтилляционных приборов ДРГЗ-01 и СРП-68-01. Точки 1, 2 и 3 находились на расстоянии 20, 50 и 126 см от установки. Контрольный образец в чашке Петри в точке 4 находился на расстоянии 126 см от установки в свинцовом стакане с толщиной стенок 2 см, экранирующим облучение установки. Вне зоны облучения в точке 5 находился экранированный от ПРФ вариант сниженного в 20 раз внешнего радиоактивного излучения ПРФ и в точке 6, в микробиологическом боксе – лабораторный контроль, который подвергался воздействию только ПРФ. Мощность дозы для изучаемых объектов составляла: в точке 1 – 2•10-2 сГр/час, в точке 2 – 2•10-3 сГр/час, в точке 3 – 2•10-4 – сГр/час, в точках 4 и 6 лабораторного контроля (ПРФ) – 2•10-5 сГр/час, в точке 5 – 1•10-6 сГр/час. Низкая мощность дозы облучения исследованных образцов дрожжей по сравнению с активностью использованной установки γ-излучения достигалась за счет помещения установки в свинцовый контейнер и размещения облучаемых чашек Петри на некотором расстоянии от установки.
Приготовление индуктора ВБИ
В 60 стерильных чашках Петри диаметром 110 мм фирмы Anambra стерильно разливали полноценную питательную среду YARD следующего состава: KH2PO4 – 2 г/л, MgSO4 – 1 г/л, (NH4)2 SO4 – 1 г/л, глюкоза – 20 г/л, дрожжевой автолизат – 20 мл/л, агар-агар – 25 г/л, пептон – 10 г/л. Перед их засевом заранее выращивали на косяке с полноценной средой YARD культуру баллистоспоровых дрожжей Sporobolomyces alborubescens Derx в течение 6 суток при + 25 °С. Этот вид дрожжей обитает на наземных частях растений, имеет экзогенные баллистоспоры на заостренных кончиках особых выростов клеток. После застывания агаровой среды чашки Петри засевали из соответствующего разведения в питательном бульоне растущими свежими клетками Sporobolomyces alborubescens Derx, которые через 6 суток роста в термостате при + 25 °С образовывали многослойные культуры с толщиной многоклеточного слоя около 2 мм. Такие чашки Петри со стерильной культурой ставились в экспериментальные точки 1-4 на столе под установкой Ц 1-6 на 6 часов для облучения. В опытной точке 5 сниженного в 20 раз ПРФ и в контрольной точке 6 вне зоны облучения (в микробиологическом боксе) индукторы (чашки Петри) также подвергались 6-часовой экспозиции. Для получения общей дозы 1•10-6 сГр чашки детектора экспонировали 1 час при мощности дозы сниженного в 20 раз ПРФ 1•10-6 сГр/час. Для каждой точки использовалось по 10 чашек в 9 различных опытах.
Приготовление детекторов ВБИ
Как и для индукторов, для детекторов также готовили 60 шт. чашек Петри с твердой полноценной средой YARD того же состава. Перед их засевом косяк с выращенной на полноценной среде культурой Sporobolomyces alborubescens Derx помещали в холодильник при + 4 °С на 2-3 месяца. Перед постановкой эксперимента микробиологической петлей брался мазок клеток из данной старой культуры на косяке, и готовили серию десятикратных разведений клеток в 4,5 мл питательного бульона. Используя рутинный метод определения количества клеток (микроскоп МБИ-2) в камере Горяева при стократном увеличении, готовили такое разведение, чтобы при высеве минимального объема суспензии клеток на детектор (одну чашку Петри) приходилось не более 104 старых клеток. Таким приготовленным стандартным разведением старых летальных клеток в одной колбе на 100 мл засевали все заранее приготовленные 60 шт. чашек Петри детектора.
Мутагенное действие ВБИ
Вместе с индукцией выживаемости летальных клеток проводили одновременно на этих же чашках Петри (детекторах) выявляли появление морфогенетических мутаций у летальных клеток после 22 суток роста. Мутантные были меньших размеров, чем нормальные, имели бледно-серый, бледно-розовый, серовато-бурый цвет. Они имели хорошо выраженное возвышение в центральной части с резким переходом к периферической части, лишь у самых мелких колоний с диаметром ≤ 0,1 мм оно не наблюдалось. Клетки этих колоний проявляли истинную мутагенность, поскольку мутантные колонии сохраняли свою морфологическую наследственную изменчивость в процессе последующих длительных пересевов.
Контрольный эксперимент
Чашки Петри засевали старой летальной культурой дрожжей так же как детекторы ВБИ, затем ставились под установкой Ц 1-6 и подвергались γ-облучению по той же схеме, что и индукторы ВБИ, облучался только детектор. После 6-часового γ-облучения чашки Петри всех вариантов ставились в термостат на + 25 °С на 6 суток, как в опыте. Выросшие колонии подсчитывались, как в опыте.
Сборка биоблока ВБИ (индуктора и детектора)
После 6-часового облучения опытные и контрольные индукторы соединялись с только что приготовленными детекторами в биосборку (биоблок) согласно приведенной схеме (рис. 1), затем их помещали в микробиологический бокс при + 20 °C на ночь. Утром следующего дня детекторы отъединяли от индукторов, закрывали стерильными стеклянными крышками и ставили на 6 суток в термостат при 25 °С, после чего производили подсчет выросших колоний во всех вариантах опыта. Мутантные микроколонии подсчитывали по группам, распределяя по диаметру колоний: ≤ 0.05 мм, < 0,1 мм, < 1 мм. Колонии диаметром 0,5-2 мм и более подсчитывали невооруженным глазом, более мелкие микроколонии – с увеличительным стеклом и иногда с бинокулярной лупой. Колонии культуры нормальных клеток были выпуклыми, оранжево-красного цвета и имели диаметр ≥ 2 мм (в среднем 5-7 мм, максимально до 10 мм).
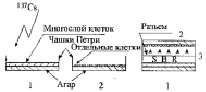
Рис. 1. Биосборка индуктора и детектора ВБИ. 1 – индуктор ВБИ, 2 – детектор ВБИ, 3 – биосборка ВБИ (SBR secondary biogenic radiation)
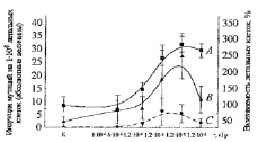
Рис. 2. Дозовая зависимость выживаемости и индукции мутаций у летальных клеток Sрогоbоlоmусеs аlborubescens Derx. (детекторов) при действии на них ВБИ излучения, генерированного γ-радиацией Сs137 в дрожжевых многослойных культурах индукторов. А – суммарная выживаемость мутантных и нормальных летальных клеток, В – общее количество колоний мутантных клеток, С – количество мутантных колоний с диаметром 0,05 мм
Результаты исследования и их обсуждение
В настоящей работе было изучено появление мутантных и нормальных клеток при оживлении летальных клеток старой 2-3 месячной культуры дрожжей S. аlborubescens Derx, являющейся детектором (преемником) излучений ВБИ, полученных от многослойной культуры растущих клеток того же вида дрожжей (индуктора ВБИ) при облучении их сверхнизкими дозами γ-радиации 137Сs. Обработанные данные, проведенные на 60 биосборках (биоблоках) детекторов ВБИ, графически представлены на рис. 2. Достоверность данных рассчитывалась по критерию Стьюдента.
Была исследована зависимость доза-эффект выживаемости летальных клеток дрожжей детектора от общей дозы γ-облучения, полученной индуктором в течение 6 часов, а также от дозы ПРФ в норме (1,2•10-4 сГр), сниженной в 20 раз (6•10-6 сГр) и в 120 раз (1•10-6 сГр). Были проведены расчеты количества возбуждений (возбужденных электронов) в атомах одной клетки, индуцированных ПРФ при общей дозе 1,2•10-4 сГр, измеренной нами за 6 часов. В расчетах учитывалось, что доза ПРФ 1 сГр вызывает в 1 мл 1,6•1012 ионизаций, на 1 ионизацию приходится 4 акта коллективного возбуждения электронов, а объем одной клетки в среднем равен 10-9 мл [16]. Расчеты показали 1,6•1012×4×10-9×1,2•10-4 = 0,77 возбуждений на 1 клетку индуктора при экспозиции в течение 6 часов только с ПРФ. На одну летальную клетку индуктора в условиях сниженного в 20 раз ПРФ (6•10-6 сГр) тогда приходится 0,04 возбуждений электронов. При сниженной в 120 раз общей дозе ПРФ (1•10-6 сГр) можно рассчитать лишь 0,0064 возбуждений, и биологический эффект ВБИ уже практически не наблюдается, при еще меньшей дозе, обозначенной буквой К, он теоретически сведен к нулю, как и на последующих рисунках. Появление эффекта на кривых A и B при увеличении дозы в 6 раз от 1•10-6 сГр до 6•10-6 сГр коррелирует с увеличением в 6 раз постоянной Планка до постоянной действия Планка, что свидетельствует о наличии осцилляций макромолекул и квантовой электромагнитной природе излучения ВБИ при воздействии ПРФ на индуктор. В опытных точках при облучении детектора излучением ВБИ, индуцированным γ-облучением в дозах 1,2•10-3 сГр, 1,2•10-2 сГр и 1,2•10-1 сГр, которые выше общей дозы ПРФ в 10, 100 и 1000 раз, были получены значения 7,7, 77 и 770 возбуждений. Были проведены также расчеты для количества поляризованных возбужденных электронов (поляритонов) в дрожжевых клетках индуктора для всех исследованных доз ПРФ и γ-облучения, эти величины были в 100 раз выше, что свидетельствовало об увеличении количества возбужденных электронов при поляризации.
При сравнении представленных на рис. 2 кривых обнаруживается куполообразный характер зависимости индукции выживаемости мутантных и нормальных летальных клеток S. аlborubescens Derx детектора от общей дозы ПРФ и γ-облучения индуктора (рис. 2, кривая А). Логарифмический рост клеток детекторов наблюдался при общих дозах облучения индуктора 1,2х10-4 сГр (ПРФ), 1,2х10-3 сГр и 1,2х х10-2 сГр (γ-излучение). Наблюдался удваивающий биологический эффект индукции выживаемости летальных клеток на этой части кривой в трех ее точках, когда для каждой последующей точки индукции выживаемости доза γ-облучения индуктора и количество возбужденных электронов увеличивались на порядок. При снижении общей дозы ПРФ в 20 раз (6•10-6 сГр) количество выживших клеток снижается также в 2 раза. Максимальные значения выживаемости достигались при общей дозе 1,2•10-2 сГр, превышающей дозу ПРФ (1,2•10-4 сГр) в лабораторном контроле на 2 порядка. Общее количество мутантных и нормальных колоний максимально увеличивалось на 113 % от 15 колоний (принятых за 100 %) на чашке Петри необлученного ВБИ контроля (ПРФ) до 32 в опыте.
Общее количество мутантных микроколоний детектора под действием ВБИ максимально увеличивалось от 8 в случае отсутствия γ-облучения индуктора (лабораторный контроль ПРФ) до 23 в опыте (рис. 2, кривая В), что свидетельствует об активном проявлении спонтанного мутагенеза (на ≈ 200 %) в старой культуре дрожжей при неблагоприятных условиях длительного хранения при низкой температуре. Значительно более высокий процент увеличения мутантных колоний по сравнению с нормальными колониями (разница значений ординаты при одной дозе на кривых А и В несущественна) указывает также на индукцию новых мутантных колоний под действием ВБИ. Кривая C (рис. 2), отражающая количество колоний мутантных клеток культуры дрожжей на примере очень маленьких колоний с диаметром 0.05 мм, расположена гораздо ниже, чем кривая B, отражающая количество колоний всех мутантных клеток. Количество этого вида колоний при данной оптимальной дозе роста меньше в 5 раз, чем общее количество трансформированных клеток.
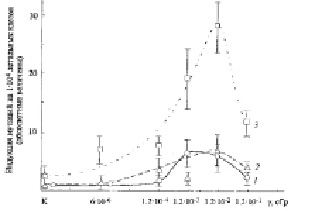
Рис. 3. Дозовая зависимость индукции мутаций у летальных клеток Sрогоbоlоmусеs аlborubescens Derx при действии на них ВБИ излучения, генерированного γ-радиацией Сs137 в дрожжевых многослойных культурах клеток индукторов. 1 – количество мутантных микроколоний с диаметром ≤ 0,1 мм, 2 – с диаметром 0,1 мм, 3 – с диаметром 0,5 мм
Индукция морфологических мутаций у колоний дрожжей различного размера, являющихся детектором ВБИ излучений, показана также на рис. 3. Представлена количественная динамика индукции мутантных клеток колоний с различным диаметром в зависимости от общей дозы ПРФ и γ-облучения индуктора.
На рис. 3 (кривые 1, 2) видно, что выход микроколоний диаметром 0,05 мм и 0,1 мм на 22 сутки роста имеет сходную количественную динамику индукции в противоположность микроколониям диаметром 0,5 мм. Максимальный выход мутаций клеток этих наиболее мелких колоний был незначителен, он увеличивался от 2 и 4 при дозе ПРФ 1,2•10-4 сГр до 7 при дозе 1,2•10-2 сГр γ-облучения (в среднем на 133 %), как и на рис. 2, что показывает их малую жизнеспособность. Увеличение мутабильности клеток микроколоний с диаметром 0,5 мм от дозы γ-облучения индуктора (рис. 3, кривая 3) была гораздо более значительным: оно происходило от 10 микроколоний при ПРФ до 28 мутантных микроколоний максимально при дозе 1,2.10-2 сГр γ-облучения (на 180 %), как и на рис. 2. Следует отметить появление необычного типа мутаций – маленьких столбообразных микроколоний, подобных миниатюрным актиниям (но только без щупальцев), с расположенными наверху колоний круглыми воронкообразными углублениями. Их было обнаружено: 8 шт./чашку Петри детектора при дозе 1,2х10-2 сГр, 6 шт./чашку при дозе 1,2х10-3 сГр и 3 шт./чашку при дозе 1,2х10-4 сГр, приходящейся на чашку Петри индуктора. В вариантах опыта сниженного в 20 и 120 раз ПРФ их не было обнаружено.
На рис. 4 представлены результаты контрольного опыта по прямому воздействию ПРФ и γ-облучения в использованных в предыдущих опытах дозах на клетки микроколоний детектора (без облучения индуктора).
Как видно из представленных на рис. 4 данных, зависимость доза-эффект имеет совершенно иной вид по сравнению с зависимостью, отражающей влияние ВБИ индуктора на такие же клетки детектора старой культуры дрожжей (рис. 2, 3). ВБИ при исследованных дозах γ-излучения детектора практически не влияло на количество микроколоний и лишь ПРФ несущественно (на 15-20 %) увеличивал количество мутантных микроколоний (рис. 4, кривые 1, 2). Некоторое ингибирование (на 20-30 %) роста мутантных клеток в самых маленьких микроколониях с диаметром ≤ 0,1 мм сниженными дозами ПРФ и исследованными дозами γ-излучения согласуется с данными незначительного влияния на них ВБИ и является еще одним свидетельством в пользу меньшей жизнеспособности клеток этих микроколоний, имеющих столь небольшой диаметр.
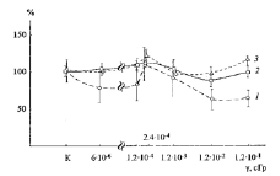
Рис. 4. Выживаемость летальных клеток Sрогоbоlоmусеs аlborubescens Derx при действии γ-радиации С137 на клетки детектора. 1 – диаметр микроколоний ≤ 0.1 мм, 2 – диаметр ≤ 1 мм, 3 – общее количество мутантных микроколоний
Сравнение данных, представленных на рис. 4 и рис. 2-3 свидетельствуют об ином, более сложном механизме действия излучения ВБИ на клетки детектора, индуцированного сверхмалыми дозами ПРФ и γ-излучения по сравнению с их прямым действием на эти клетки в тех же дозах. Данные контрольного опыта (рис. 4) предоставляют еще одно доказательство в пользу обнаруженной нами зависимости доза-эффект от излучений ВБИ возбужденных поляризованных электронов (рис. 2-3), показывающей индукцию мутагенеза и появление нормальных и мутантных клеток при «оживлении» старой культуры дрожжей. ПРФ и γ-излучение вызывает сходные митогенетические изменения, индуцированные, вероятно, сходными изменениями на молекулярном уровне – возбуждением конденсированных биополимеров с осцилляционными составляющими, приводящим к появлению ВБИ – излучению возбужденных поляризованных электронов (поляритонов). Приведенные экспериментальные данные свидетельствуют как об истинном индукционном мутагенном действии ВБИ, так и косвенном (побочном), когда ВБИ способствует выявлению мутантных клеток, потенциально присутствующих в старых летальных культурах дрожжей. Выявить подобные мутации из летального состояния может только ВБИ-излучение, которое называют «лучами жизни». При уменьшении интенсивности ВБИ, индуцированного сниженным в 10 раз ПРФ, количество выживших нормальных и мутантных летальных клеток снижается в 2 раза, что указывает на необходимость естественного фона радиации для нормальной жизнедеятельности и митогенной активности дрожжевых клеток.
Настоящее сообщение посвящено изучению биологического действия на клетки дрожжей сверхслабых вторичных биогенных излучений (ВБИ), индуцированных при воздействии γ-облучения на клетки того же вида баллистоспоровых дрожжей. Первичные биогенные излучения (ПБИ) могут испускаться клетками, структурами и молекулами биологического объекта также без воздействия извне физическими факторами. К таким излучениям относятся митогенетические лучи Гурвича клеток вблизи зоны роста корешков лука, которые стимулировали рост и деление клеток корешков, находящихся вне зоны роста. Гурвич предполагал, что если белки активно поглощают ультрафиолет (λ = 160, 230 и 280 нм), то они должны спонтанно излучать в той же области [6]. Впоследствии аналогичные опыты с наземными частями высших растений провел Кузин с соавт. [12, 13]. Стеклянная пластинка снимала эффект излучения, кварцевая нет. Был сделан вывод о том, что эффект обусловлен не химическими воздействиями, а какими-то излучениями, и было предположено, что электромагнитным ультрафиолетовым излучением (УФИ). Облучение УФ светом из внешних, технических источников к специфическому стимулированию, как правило, не приводило, что свидетельствовало о множественной природе происхождения митогенетических лучей, стимулирующих митоз.
Б.Н. Тарусов и др. (1961) обнаружили другой вид ПБИ – биохемилюминесценцию (БХЛ). БХЛ имела квантовую природу и проявлялась в виде сверхслабого эндогенного спонтанного прижизненного свечения в области видимого света с λ = 360-1200 нм [6]. Свечение липидов, выделенных из тканей, было на 1-2 порядка выше, чем свечение органов животных в том же диапазоне, что являлось доказательством того, что липиды генерируют электронные возбужденные состояния и являются источником БХЛ. Эти излучения являлись индикаторами образования в клетке свободных радикалов (СР) липидов, их увеличение сверх физиологической нормы при физических воздействиях и стрессах, приводящее к различным патологиям организма человека, сопровождалось увеличением БХЛ. Эти излучения являлись отражением других биологических процессов в клетке по сравнению с лучами Гурвича и создавались магнитным полем, создаваемым неспаренными электронами СР [6].
Сверхслабые биогенные излучения, индуцированные в молекулах и структурах биологических объектов путем облучения их различными физическими факторами, называются ВБИ. Зарубежные ученые R.H. Dicke (1964), J. Bednar (1985), F. Popp (1989), K.H. Li (1992), облучавшие биологические высокомолекулярные конденсированные молекулы (ДНК, белки) ультрафиолетом, установили, что они в течение 1-2 часов испускают ВБИ, а именно слабый видимый свет (излучение Вавилова-Черенкова) [13] – фотонное излучение, представляющее собой колебания электромагнитного поля. Они полагали, что поглощенная мономерами энергия делокализуется в электронном облаке конденсированного полимера, взаимодействует с механической энергией осцилляции макромолекулы, образуя устойчивые, долгоживущие энергетические центры (поляритоны). Эти центры являются источником последующего когерентного излучения с энергией, значительно меньшей энергии возбуждения – ВБИ. Кузиным и др. был экспериментально показан феномен излучения ВБИ, индуцированного γ-облучением различных биологических объектов (индукторов) [11-13]. Митогенетический феномен ВБИ проявлялся в стимуляции митоза клеток и стимуляции роста и развития живых организмов после γ-облучения [11-13]. Было предположено сходство ВБИ с лучами Гурвича, поскольку в этих опытах стеклянная пластинка также предотвращала эффект ВБИ, а кварцевая нет [20]. Согласно экспериментальным данным эффект ВБИ наблюдался при небольшом расстоянии между индуктором и детектором (1-3 см). Эффект сохранялся в течение непродолжительного времени (15-30 мин. после облучения) [13].
В настоящем сообщении нами было исследовано биологическое действие ВБИ, индуцированного в многослойной культуре баллистоспоровых дрожжей Sporobolomyces alborubescens Derx облучением сверхмалых доз сниженного в 20 и 120 раз ПРФ, 1,2•10-4 сГр ПРФ и в 10, 100, 1000 раз более высоких (чем ПРФ) доз γ-радиации 137Cs источника, на летальные старые клетки этих дрожжей. На куполообразной кривой доза-эффект максимальные эффекты ВБИ, связанные с увеличением мутантных и нормальных клеток дрожжей (на 113 %), наблюдались при дозе γ-облучения 1,2.10-2 сГр, превышающей дозу ПРФ в контроле на 2 порядка. Ранее на «полетных» семенах томатов, подвергшихся 6-летнему космическому полету и в земных условиях воздействию ВБИ дрожжей, также облученных сверхнизкими дозами γ-облучения, максимальный эффект по увеличению их всхожести (на ≈ 50 %) и выявления мутаций был получен при меньшей дозе γ-облучения 1,2.10-4 сГр, соответствующей дозе ПРФ в контроле [22], что свидетельствовало о большей чувствительности семян к ВБИ. Существенное увеличение общего количества мутантных клеток микроколоний на ≈ 200 % (рис. 2, кривая В) в данной работе выявляет высокую эффективность ВБИ по выявлению скрытых мутаций в культуре старых летальных клеток дрожжей. Значительное превышение количества мутантных клеток над выживаемостью нормальных клеток указывает на индукцию новых мутантных клеток под воздействием ВБИ.
Обнаруженный нами активный мутагенез, связанный с цитогенетическими нарушениями и повреждениями ДНК в клетках дрожжей Sporobolomyces alborubescens Derx при воздействии ВБИ, индуцированного сверхмалыми дозами γ--радиации свидетельствует о сверхчувствительности дрожжевых клеток к сверхнизким дозам излучений, что можно объяснить асинхронностью работы систем повреждения и репарации. Повышенная радиочувствительность в диапазоне сверхмалых доз связывается также с молчанием системы репарации, для включения которой требуется переход порогового уровня повреждения ДНК, после которого происходит включение системы репарации и увеличение выживаемости нормальных клеток [2, 21]. Результаты нашей более ранней публикации [18] подтверждают эти выводы: действие на клетки этих дрожжей ВБИ, полученных при более высоких дозах γ--облучения семян ячменя, индуцирующих более интенсивные ВБИ, оживляли в основном нормальные клетки [18] в отличие от индукции в большей степени мутантных клеток сверхнизкими дозами γ-радиации в настоящей работе. Снижение количества мутаций в наших опытах после достижения максимальных значений на куполообразной кривой зависимости доза-эффект можно объяснить включением адаптационных систем клеток дрожжей. Происходит снижение уровня продуктов перекисного окисления липидов (вследствие мобилизации антиокислительного механизма защиты), наблюдается активация каскадного механизма реакций на повреждение, задержка клеточного цикла и усиление работы системы репарации ДНК в выжившей популяции клеток [21].
Молекулярный механизм действия малых доз γ--облучения, стимулирующих рост, развитие и размножение живых организмов, сверхмалых доз излучений ПРФ и ВБИ, индуцированного малыми дозами γ--облучения, лежащими за порогом их летального действия, был предложен А.М. Кузиным [20] на основании данных, полученных сотрудниками своей лаборатории, предложенных им гипотез и литературных данных ряда зарубежных авторов: воздействие излучений на биополимеры живой клетки – белки, нуклеиновые кислоты, хроматин, осуществляется путем возбуждения электронов (поляритонов) в этих молекулах. Если при ионизации, связанной с воздействием на молекулы живых организмов больших доз радиации, электроны отрываются от атомов, и происходит разрушение структуры молекулы, то при возбуждении молекулы электроны переходят на более высокие энергетические уровни, а молекула, наоборот, – в активное, реакционно способное состояние. ВБИ создает электромагнитное поле, несущее молекулам, клеткам и органам биообъектов митогенетическую информацию путем воздействия на их биополя также электромагнитной природы [11]. При дополнительном γ--облучении увеличивается поглощенная энергия в биополимерах, растет интенсивность ВБИ клеток [20].
Данные современной квантовой физики позволяют уточнить положения теории А.М. Кузина, изложенные выше. Возбужденный электрон переходит на более высокий энергетический (низший незаполненный) уровень, в таком возбужденном состоянии он может находиться очень непродолжительное время – 8-10 сек. Возбужденный электрон называется экситоном, он несет потенциальную энергию, необходимую для химической реакции. Затем электрон возвращается на основное прежнее место, при этом он излучает квант света, который передает соседнему атому, результатом является электронное возбуждение нового атома. Когда происходит миграция электронного возбуждения от атома к атому, наблюдается коллективное возбуждение атомов, изменяется величина электромагнитного поля, и происходит излучение электромагнитных волн, являющихся ВБИ. Эффективность ВБИ увеличивается при коллективном возбуждении электронов в атомах и биологических молекулах [14]. Солитон – отдельная волна электромагнитного излучения (ЭМИ), распространяющаяся в нелинейной среде, она может эффективно переносить энергию возбуждения на значительные расстояния. Взаимодействие коллективных колебаний электронов и других элементарных возбуждений среды с квантами света определенной частоты приводит к образованию поляритонов – возбужденных электронов с поляризационными колебаниями. Мы полагаем, что энергия поляризованной компоненты реликтового излучения (РИ), являющегося сверхслабым космическим фотонным излучением СВЧ ЭМИ, может поглощаться возбужденными электронами атомов путем ЯМР и ЭПР, при этом атомы начинают излучать поляризованное сверхслабое СВЧ ЭМИ – излучение ВБИ [20, 21]. Нами был разработан магнитно-резонансный механизм возникновения поляризованного излучения, в частности, излучения ВБИ, базирующегося на эффекте Зеемана с синергическом (когерентным) действием при наложении зеемановского расщепления на штарковское [4, 5]. Сверхслабые излучения при их поляризации могут иметь коэффициент усиления воздействия, равный 104 [5]. Увеличение эффективности поляризованного излучения происходит, по всей вероятности, за счет дополнительных колебаний напряженности его электрического поля, в результате индуцируются дополнительные колебания электронов и атомов биологического объекта.
Биологическую митогенетическую эффективность сверхслабого ПРФ можно также объяснить действием поляризованной компоненты РИ [5]. Это было подтверждено в работе Даровских и др. [3] на примере исследования биологического действия аналога реликтовой составляющей ПРФ – ЭМИ аппарата медицинской магниторезонансной терапии с длиной волны λ = 4,1-4,3 ГГц, близкой к средней частоте РИ (4,08 ГГц), и интенсивностью (100 мкВт/см2), превышающей таковую РИ на два порядка. Показано противовоспалительное, восстанавливающее, противоотечное, анальгезирующее и противоспазмолитическое действие в клинических условиях. Теоретически обосновывая молекулярный механизм исследованного вида излучения, авторы подчеркивают важность резонансного характера действия излучения на биологические объекты, позволяющего усиливать воздействие возбужденного состояния атомов, возвращение которого в стационарное состояние будет приводить к излучению ВБИ электромагнитной природы. Резонансные свойства излучения в наибольшей степени, по мнению авторов, выражены у металлоферментов с гемовой группой, депротонирование которых приводит к восстановлению их ферментативных свойств, дыхания и запасания энергии в клетке, снятию гипоксии.
Мы полагаем, что усиление активности ВБИ может происходить при увеличении биологической эффективности на клетках индуктора использованного нами сверхслабого γ-излучения квантов, являющегося СВЧ ЭМИ, за счет проявления его резонансных свойств в различных биологических структурах, органеллах и молекулах клетки (клеточных мембран, митохондрий, ядра, ДНК генома, рибосом, эритроцитов и др.), поскольку на основании экспериментальных данных Илларионова [7] они излучают электромагнитные колебания с частотами в области СВЧ ЭМИ. Нами было показано противоопухолевое и радиозащитное действие сверхслабых СВЧ ЭМИ с интенсивностью, сравнимой с таковой ПРФ [1, 24], что предполагает не энергетическую, а сигнальную информационную природу получаемых эффектов [8]. Экспериментальные данные других авторов свидетельствовали, что под влиянием малых и сверхмалых доз γ-радиации происходит возбуждение молекул белков и нуклеиновых кислот и передача энергии этого возбуждения в виде ВБИ другим биообъектам [20], при этом может изменяться пространственная структура (конформация) белковых рецепторов и ферментов, регулирующих метаболизм клетки и стимулирующих клеточную пролиферацию, при этом ключевая роль в регуляции деления клетки и развития организма отводится мембранным рецепторам, которые могут изменять конформацию также под влиянием ЭМИ, ростовых факторов, гормонов. Нами было показано, что вода может передавать биологический эффект сверхслабых СВЧ ЭМИ семенам, способствуя их прорастанию [23], КВЧ ЭМИ, способствуя транспорту К+ через Са2+-каналы культуральных клеток печени [25]. Было обнаружено ускорение конвекции облученной воды и изменение транспорта протонов через бислойные липидные мембраны в присутствии протонофоров, получены экспериментальные доказательства дегидратации низкомолекулярных молекул под действием СВЧ ЭМИ, что может быть связано с изменением кластерной структуры воды. Активацию прорастания семян при действии облученной воды мы связываем также с изменением конформации и активности ферментов, участвующих в образовании энергии и транспорте ионов в митохондриях, образованием СР в низких концентрациях и поляритонов в лигнине оболочки семян, белках и липидах клеточных мембран [9].
Таким образом, обобщение данных, касающихся молекулярного механизма действия ВБИ показало, что возбужденные молекулы воды, биологические структуры и молекулы индуктора, получившие дополнительную энергию сверхслабого ПРФ и/или γ-излучения и испускающие ВБИ в виде СВЧ ЭМИ, могут передавать ее таким же структурам и молекулам других живых организмов (детектора), имеющим близкие частоты электромагнитных колебаний. Излучение УФ, которое является активной составляющей ВБИ при действии на биологические объекты [20], также относится к СВЧ ЭМИ. Полученные ранее данные о связи биологической структуры и их функции при действии ПРФ и атомной радиации [10] могут быть теперь дополнены нашими знаниями об электромагнитных полях, образуемых ВБИ и создающих связи между клеточными структурами и реакциями метаболизма целого организма [5, 18, 22]. ПРФ и γ-излучение в сверхмалых дозах следует рассматривать не как высокоэнергетическое ионизирующее вмешательство в клеточные процессы, а прежде всего как низкоэнергетический информационный сигнал для поддержания клетки в активном состоянии. Таким образом клетка получает пусковой триггерный сигнал от ПРФ и γ-облучения сверхнизких доз через ВБИ. Из данных контрольного эксперимента настоящей работы (рис. 4) можно заключить, что первично полученной старыми клетками дрожжей энергии сверхслабых ПРФ и γ-излучения может быть не достаточно для проявления биологического эффекта, и лишь излучение ВБИ, индуцированное этими излучениями, в наших экспериментах было способно оживить культуру летальных клеток дрожжей, способствуя резонансным колебаниям полей СВЧ ЭМИ многих видов молекул и структур клетки и поляризации внутриклеточных излучений СВЧ ЭМИ.
Научное значение настоящей работы заключается в выявлении биологической роли излучений ВБИ, индуцированных сверхмалыми дозами ПРФ и γ-облучения. Впервые нами было выявлено эффективное действие ВБИ на мутагенез клеток дрожжей при очень низкой, сверхмалой дозе γ-облучения сотен и тысячных долей сГр, индуцирующей ВБИ, в отличие от дозы десятков сГр и целых единиц Гр, использованной в более ранних исследованиях на других биологических объектах [13, 18] и стимулирующих, наоборот, жизненные процессы (гормезис). Аналогичные закономерности были получены при изучении влияния биологически активных веществ, для которых в области сверхмалых доз отмечалась ингибирующая активность, а по мере роста концентрации она сменялась стимулирующей, а затем вновь ингибирующей [2, 21]. Похожие зависимости наблюдаются и при воздействии СВЧ ЭМИ, на кривой зависимости величины физиологического эффекта от плотности мощности облучения наблюдаются два максимума [5, 21]. Таким образом, общей закономерностью эффекта действия химических веществ и физических факторов (излучений) является наличие их бимодальных дозовых зависимостей с двумя максимумами. Ответ живого организма на определенные дозы воздействия основывается на широко известном биологическом законе Арндта – Шульца, согласно которому слабые раздражители возбуждают, средние – стимулируют, сильные – тормозят, максимальные – парализуют жизнедеятельность организма, что связано с различными механизмами их воздействия. Универсальная зависимость фазовой реакции биосистемы от возрастающего физического стимула приводится нами ранее [5]. Практическое значение может быть связано с производствами, в которых используются дрожжевые культуры: γ-облучение некоторого количества молодых клеток дрожжей сверхнизкими дозами и внесение его в культуру дрожжей, хранившуюся в течение длительного времени, может способствовать ее оживлению. Использование ПРФ и его отдельных компонент при соответствующих дозах ПРФ возможно в медицине [3].
В заключение следует отметить, что из литературных данных известно, что в ходе эволюции рецепторная и адаптационная системы приобрели способность реагировать на сигналы малой интенсивности. Полученные в последние годы результаты исследований указывают на то, что γ-облучение в малых дозах вызывает многочисленные структурные перестройки в клеточных мембранах, которые длительное время после облучения сохраняются и приводят к изменению активности транспорта ионов и запасания энергии, изменению функциональной активности клеток. Известные радиобиологи нашей страны Кузин А.М., Эйдус Л.Х., Кудряшов Ю.Б. приводят доказательства того, что клеточные мембраны (а не ДНК) являются первичной мишенью радиации в малых дозах, в отличие от эффектов больших доз, которые вызывают ионизацию и разрывы молекул ДНК [10]. Приведенные собственные и литературные данные указывают на то, что живые организмы различных уровней организации также адаптированы в процессе эволюции к периодическому получению сверхслабых сигналов ПРФ и ВБИ, которые играют важную роль в их развитии, нормальном росте и размножении. Из результатов данной работы следует, что древние формы жизни – дрожжи – могут реагировать на сверхмалые сигналы излучений ВБИ, индуцированных сверхнизкими дозами ПРФ и γ-облучения, приводящими к появлению мутаций в культуре летальных клеток, связанному с недостаточной активностью адаптационных систем к столь низким дозам радиации, однако это приводит к расширению спектра естественных мутаций, что необходимо для последующего естественного отбора наиболее полезных и нужных для живых организмов свойств в процессе эволюции жизни на Земле. Излучение ПРФ, состоящее из космических излучений, в первую очередь исходящих от Солнца и центра Вселенной (РИ), и излучений природных радионуклидов, а также ВБИ могли служить мощным эволюционным фактором зарождения и развития жизни на Земле. Поддерживая взаимодействие живых организмов между собой и с окружающей средой, эти излучения являются важными экологическими факторами. Влияние солнечной активности на биосферу Земли может опосредоваться изменениями электромагнитных полей, инфразвуковыми колебаниями и флуктуациями интенсивности УФИ в атмосфере Земли. Во Вселенной электромагнитные и гравитационные поля являются фундаментальными.
Выводы
1. В настоящей экспериментальной работе, проведенной на культуре старых летальных клеток баллистоспоровых дрожжей Sporobolomyces alborubescens Derx., впервые обнаружен дозозависимый эффект ВБИ, имеющий куполообразную зависимость по выходу мутантных и нормальных клеток при различных сверхмалых дозах ПРФ и γ-облучения от изотопа 137Cs, индуцирующих ВБИ. Согласно литературным и собственным данным использование высоких доз γ-излучения в десятки и сотни Грэй не позволяло выявлять дозозависимый и оживляющий эффект ВБИ на этой старой культуре дрожжей ввиду их низкой жизнеспособности при этих дозах.
2. Определена начальная оживляющая доза ПРФ, индуцирующая ВБИ, равная 6.10-6 сГр, в 6 раз превышающая неэффективную дозу. Зависимость доза-эффект имела логарифмический возрастающий участок с удваивающей эффект дозой ПРФ 1,2.10-4 сГр и дозами 1,2.10-3 сГр и 1,2.10-2 сГр γ-излучения. Максимальный эффект достигался при дозе 1,2.10-2 сГр γ-излучения.
3. Впервые выявлено эффективное действие ВБИ на мутагенез клеток дрожжей при сверхмалой дозе γ-облучения дрожжевых клеток индуктора, связанное с малоэффективной работой системы восстановления (адаптации). Из экспериментальных данных работы можно сделать вывод о том, что выявлялись летальные и вновь индуцированные мутации.
4. Из данных контрольного эксперимента настоящей работы можно заключить, что первично полученной старыми клетками дрожжей энергии сверхслабых ПРФ и γ-излучения не достаточно для проявления биологического эффекта, и лишь излучение ВБИ, индуцированное этими излучениями, способно оживить культуру летальных клеток дрожжей.
5. Согласно положениям квантовой физики и литературным данным, касающимся биологического действия ВБИ, физическим фактором, причастным к передаче информации от облученного индуктора к реципиенту (детектору) ВБИ, являются излучения СВЧ ЭМИ, исходящие от молекул воды, конденсированных биологических молекул (белков, нуклеиновых кислот) и различных клеточных структур и органелл индуктора.
6. Регуляторная роль ВБИ может быть связана с действием на клеточные рецепторы, мембраны и ДНК. Усиление эффективности биологического действия ВБИ может происходить за счет увеличения его активности при проявлении его резонансных свойств в структурах и молекулах детектора, при поляризации ВБИ квантами света и реликтового излучения.
Авторы приносят благодарность за оформление статьи и обсуждение результатов к.б.н. Кожокару Н.Л.
Библиографическая ссылка
Кожокару А.Ф., Юров С.С., Дмитриевский И.М. ДЕЙСТВИЕ НА БАЛЛИСТОСПОРОВЫЕ ДРОЖЖИ ВТОРИЧНОГО БИОГЕННОГО ИЗЛУЧЕНИЯ, ИНДУЦИРОВАННОГО СВЕРХСЛАБЫМ ГАММА-ОБЛУЧЕНИЕМ И ПРИРОДНЫМ РАДИАЦИОННЫМ ФОНОМ // Международный журнал прикладных и фундаментальных исследований. – 2016. – № 10-3. – С. 431-441;URL: https://applied-research.ru/ru/article/view?id=10365 (дата обращения: 18.04.2024).

