В нитрозном процессе реакционная способность нитрозы зависит от степени гидролиза нитрозилсерной кислоты (НСК). Химическая активность нитрозы определяется концентрацией лишь тех соединений азота, которые находятся в растворе в свободном состоянии, а эти соединения являются продуктами гидролиза НСК. Гидролиз НСК имеет большое технологическое значение, но в силу экспериментальных трудностей был мало исследован. Исследовать реакцию гидролиза НСК с применением обычных химико-аналитических методов контроля невозможно. Равновесная концентрация НСК или продуктов ее гидролиза в нитрозе не могут быть определены обычными химическими методами анализа. Для изучения равновесия этой реакции могут быть применены физические методы контроля – спектрографический анализ на содержание НСК и продуктов гидролиза или кондуктометрический по изменению электропроводности нитрозы. Однако оба метода не лишены недостатков. При спектрографическом анализе поглощение света растворов нитроз представлено аддитивной функцией концентрацией НСК и продуктов ее гидролиза и коэффициент поглощения света принят независящим от температуры. Кроме того, при исследовании равновесия реакции гидролиза НСК принят неизменным механизм реакции в пределах концентрации 57,5 – 100 % H2SO4, причем степень гидролиза для 57,5 %-й серной кислоты принято равной 1 (100 %), а для моногидрата серной кислоты – 0. Кондуктометрический метод также является приближенным, поскольку в концентрированных растворах электропроводность зависит не только от степени гидролиза НСК, но и от вязкости нитрозы. Установить поправку на изменение вязкости растворов серной кислоты с изменением нитрозности раствора чрезвычайно сложно. Поэтому, изменение удельной электропроводности нитроз относительно исходной серной кислоты, как функции концентрации кислоты, нитрозности и температуры принято пропорциональным изменению степени гидролиза НСК. Других методов исследования равновесия реакции гидролиза НСК нет. Поэтому были использованы эти методы. Полученные данные являются приближенными, но точность их приемлема для прикладных расчетов.
Цель исследования. Целью работы явилось исследование гидролиза нитрозилсерной кислоты в зависимости от нитрозности раствора 4,0–0,2 % N2O3 и температуры 293–403 К и равновесного парциального давления оксидов азота (II) и (III), азотной кислоты над нитрозами в интервале температур 293 – 443 К и нитрозности раствора 4,0–0,5 % N2O3 при массовой доле исходной серной кислоты 73 %.
Материалы и методы исследования
Для исследования нитрозы готовили путем растворения кристаллов нитрозилсерной кислоты в серной кислоты с массовой долей исходной серной кислоты 73 %. Методика проведения экспериментов и обработки полученных данных по гидролизу описаны ранее [5, 9], а по определению равновесного парциального давления оксидов азота и азотной кислоты [2, 8]. Статика реакции гидролиза НСК была исследована с использованием спектрофотометра СФ-46 [5].
Результаты исследования и их обсуждение
Исследования показали, что в нитрозном процессе при разбавлении кислоты до 74–73 % H2SO4 вызывает значительные увеличения интенсивности переработки SO2 [1], а в производстве энергонасыщенных материалов позволяет достичь глубокой степени денитрации [4, 6, 7]. По-видимому, это обусловлено тем, что при концентрации 73 % H2SO4 наблюдается ряд аномальных явлений: имеется излом графика по равновесному парциальному давлению оксидов азота, теплота парообразования оксидов азота из нитрозы достигает максимального значения, а растворимость NO – минимального значения, это точка взаимного перехода гидратов H2SO4·4H2O - H2SO4·2H2O и ниже этой концентрации происходит резкое повышение коэффициентов активности оксидов азота в нитрозах. В таблице 1 представлены результаты исследования гидролиза НСК с массовой долей исходной серной кислоты 73 %.
Как видно из таблицы при нитрозности 0,2 % N2O3 рост температуры с 293 до 373 и 403 К повышает степень гидролиза НСК с 23,5 до 32,7 и 37,7 % (в 1,39 и 1,60 раз), а при нитрозности 4,0 % N2O3 степень гидролиза возрастает соответственно с 74,7 до 78,1 и 80,0 % (в 1,05 и 1,07 раз). При температуре 293 К повышение нитрозности раствора с 0,2 до 1,5 и 4,0 % N2O3 увеличивает степень гидролиза НСК с 23,5 до 67,3 и 74,7 % (в 2,87 и 3,18 раз), а при 403 К с 37,7 до 79,1 и 80,0 % (в 2,01 и 2,12 раз).
Факторы, обуславливающие гидролиз НСК, повышают и равновесное парциальное давление оксидов азота над нитрозой [2, 5, 9]. Очевидно, что парциальное давление оксидов азота над нитрозой обусловлено наличием в ней не самой НСК, а содержанием продуктов ее гидролиза. Отсюда напрашивается вопрос, нельзя ли установить связь между равновесным парциальным давлением оксидов азота и степенью гидролиза НСК.
Таблица 1
Степень гидролиза НСК (α, %) при нитрозности раствора (CN2O3, %) от температуры
|
Температура, К |
Степень гидролиза НСК (α, %) при нитрозности раствора (CN2O3, %) от температуры |
||||
|
4,0 |
2,5 |
1,5 |
0,5 |
0,2 |
|
|
293 |
74,7 |
69,6 |
67,3 |
53,6 |
23,5 |
|
323 |
76,1 |
71,2 |
69,8 |
56,4 |
28,2 |
|
353 |
77,2 |
75,1 |
73,4 |
59,3 |
30,6 |
|
373 |
78,1 |
77,0 |
75,9 |
60,9 |
32,7 |
|
383 |
78,7 |
77,9 |
77,8 |
61,9 |
35,1 |
|
393 |
79,4 |
78,8 |
78,0 |
62,8 |
36,6 |
|
403 |
80,0 |
79,7 |
79,1 |
63,8 |
37,7 |
На рис. 1 приведена зависимость изменения суммарного давления и степени гидролиза НСК в относительных единицах от массовой доли исходной серной кислоты при нитрозности 2,5 % и температурах 293 и 373 К, а на рис. 2 представлена такая же зависимость от температуры при нитрозности раствора 0,5 и 4,0 % N2O3.
Для нитрозы с массовой долей серной кислоты 60 % – степень гидролиза НСК и равновесные парциальные давления приняли за 1, поэтому представленные на этих рисунках кривые в относительных единицах выражают изменение степени гидролиза и равновесного парциального давления от температуры и массовой доли исходной серной кислоты, а также от нитрозности раствора. Как видно из рисунка 1, на оба показателя доля серной кислоты действует в одном направлении, но количественная зависимость разная. При росте доли серной кислоты с 60 до 65 и 73 % степень гидролиза меняется в отношении 1 : 0,843 : 0,770, а суммарное давление 1 : 0,516 : 0,260, то есть гораздо резче. Таким образом, между степенью гидролиза и равновесным давлением нет простой зависимости. Будучи, в какой то мере связаны между собой, эти два равновесия (гидролиз НСК и равновесное парциальное давление оксидов азота над нитрозой) не повторяют друг друга. Переход от гомогенного равновесия в нитрозе к гетерогенному равновесию между нитрозой и газовой фазой, по-видимому, осложнены какими то дополнительными явлениями, которые и нарушают пропорциональность. Поэтому равновесные парциальные давления оксидов азота над нитрозой не является показателем, по которому можно судить количественно о концентрации продуктов гидролиза в нитрозе и оценивать степень гидролиза НСК и наоборот.
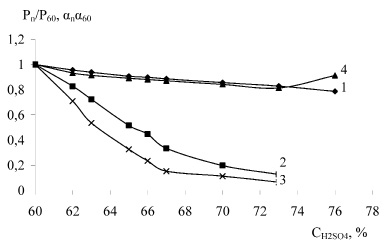
Рис. 1. Ход изменения суммарного давления (2, 3) и степени гидролиза НСК (1, 4) в относительных единицах от массовой доли исходной серной кислоты при нитрозности 2,5 % N2O3 и температурах 293 (3, 4) и 373 К (1, 2)
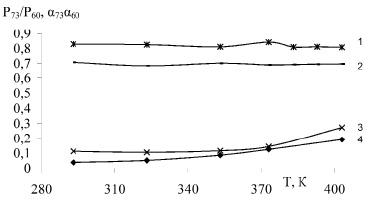
Рис. 2. Ход изменения суммарного давления (3, 4) и степени гидролиза (1, 2) НСК в относительных единицах от температуры при нитрозности 1, 4 – 4,0 %, 2, 3 – 0,5 % N2O3
При повышении температуры с 293, 353 и 403 К (рисунок 2) степень гидролиза меняется в отношении 0,828 : 0,841 : 0,807 (при нитрозности 4,0 % N2O3) и 0,817 : 0,832 : 0,843 (при нитрозности 1,5 % N2O3), а равновесное давление – 0,026 : 0,117 : 0,193 и 0,108 : 0,114 : 0,181. И здесь равновесное давление меняется гораздо резче, чем степень гидролиза и нет простой связи между величинами. Этого можно было ожидать, поскольку повышение температуры приводит не только к росту концентрации продуктов гидролиза НСК, но и к изменению коэффициента Генри, выражающего равновесное соотношение между содержанием оксида азота в газовой и жидкой фазах.
На рисунке 3 представлены кривые изменения суммарного давления и степени гидролиза от нитрозности раствора в относительных единицах при температурах 393 и 403К. Как видно из рисунка 3, при повышении нитрозности раствора с 0,5 до 2,5 и 4,0 % N2O3 степень гидролиза меняется в отношении 0,708 : 0,813 : 0,828 при 393 К и 0.697 : 0,832 : 0,807 при температуре 403 К. И здесь суммарное давление меняется гораздо резче, чем степень гидролиза, и отсутствует простая пропорциональность.
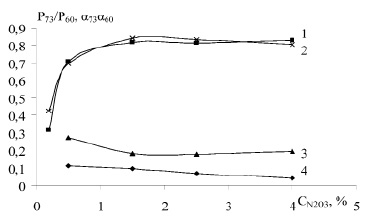
Рис. 3. Ход изменения суммарного давления (3, 4) и степени гидролиза (1, 2) НСК в относительных единицах от нитрозности раствора при температурах 293 (1, 4) и 403 (2, 3) К
Такие же зависимости были определены и для равновесного парциального давления оксидов азота (II) и (III) и азотной кислоты. Практические закономерности изменения относительных величин равновесного парциального давления оксидов азота (II) и (III), а также азотной кислоты и степени гидролиза нитрозилсерной кислоты от массовой доли исходной серной кислоты, нитрозности раствора и температуры аналогичны зависимостям суммарного давления от указанных параметров.
Полученные данные нужны не только для расчета процесса денитрации ОСК, но и для уточнения схемы гидролиза НСК [3].
Выводы
1. Изучен гидролиз нитрозилсерной кислоты в интервале температур 293 – 403К и нитрозности раствора 0,2 – 4,0 % N2O3 при массовой доле исходной серной кислоты 73 %.
2. Проведен анализ изменения гидролиза нитрозилсерной кислоты и суммарного давления оксидов азота и азотной кислоты в относительных единицах при изменении исходной серной кислоты 60 – 73 %, а также от температуры 293 – 403 К и нитрозности раствора 0,2 – 4,0 % N2O3.
3. Полученные данные будут использованы для расчета процесса денитрации и оборудования, а также для выяснения механизма гидролиза нитрозилсерной кислоты.
Библиографическая ссылка
Ким П.П., Петровский А.М., Чубенко М.Н., Комаров В.А., Перетрутов А.А. ГИДРОЛИЗ НИТРОЗИЛСЕРНОЙ КИСЛОТЫ И ДАВЛЕНИЕ ПАРОВ ОКСИДОВ АЗОТА НАД НИТРОЗОЙ С МАССОВОЙ ДОЛЕЙ ИСХОДНОЙ СЕРНОЙ КИСЛОТЫ 73 % // Международный журнал прикладных и фундаментальных исследований. – 2016. – № 12-2. – С. 196-200;URL: https://applied-research.ru/ru/article/view?id=10805 (дата обращения: 16.04.2024).

