Проблема стойкого анодного материала важна при электролизе агрессивных сернокислотных сред, в частности при экстрагировании цинка и меди, электролитическом хромировании, регенерации отработанных растворов. Основным процессом на аноде в этих случаях является выделение кислорода. Электрохимические методы регенерации позволяют одновременно извлекать ценные продукты (на катоде) и восстанавливать концентрацию серной кислоты (в анодном пространстве). Материал, конструкция электрода определяют расход электроэнергии, продолжительность эксплуатации. Выбор материала и конструкции ограничен вследствие высокой коррозионной активности сред и наличия анодной поляризации.
В настоящее время для вышеперечисленных целей используют все в большей мере так называемые составные композиционные электроды, в которых на малоизнашиваемую токоподводящую основу из титана нанесен активный слой, чаще всего из оксидов благородных металлов, выполняющий роль анода. Основными недостатками этих электродов являются трудоемкость и многостадийность изготовления, дефицитность благородных металлов, высокая стоимость. Поэтому представляет практический интерес возможность направленного синтеза высокоактивных анодов с длительным сроком службы на основе более доступных оксидов неблагородных металлов.
При эксплуатации изменение характеристик составных анодов (потенциал, селективность, срок службы) связано одновременно как с изменением состояния поверхностного слоя титановой основы, так и с превращениями в самом активном слое. Изменения в обеих составляющих зависят от условий протекания основного процесса (состав электролита, плотность тока, поляризация, длительность протекания тока) [1]. Таким образом, в любых новых условиях необходимо определять и оптимизировать характеристики как самой титановой основы, так в целом и электрода с активным слоем, нанесенным на эту основу.
Цель работы – определение характеристик и выбор титановой основы в условиях регенерации отработанных сернокислых растворов для последующего нанесения активного слоя. В представленной работе определялись характеристики монолитных и пористых металлокерамических титановых основ при анодной поляризации в отработанном сернокислом растворе, при его регенерации. Высокая коррозионная стойкость титана обеспечивается образованием на его поверхности защитных оксидных пленок [2].
В серной кислоте титан сохраняет устойчивость только до 5 % концентрации, после чего начинается коррозия, которая с увеличением концентрации серной кислоты возрастает. На кривой зависимости скорости коррозии от концентрации кислоты имеется два максимума, соответствующие концентрациям 40 и 78 %, между которыми находится минимум скорости коррозии. С увеличением температуры скорость коррозии титана сильно возрастает [3]. Анодное растворение титана в активной области потенциалов происходит с образованием трехвалентных ионов. При поляризации титана в серной кислоте до потенциала около +2 В начинается новый электродный процесс, соответствующий выделению кислорода. Процесс выделения кислорода на титане идет с высоким перенапряжением и с очень малой скоростью (низкий поляризационный ток), что связано с сильным торможением, оказываемым этому процессу параллельным текущим процессам образования анодной оксидной пленки. Пассивное состояние не нарушается даже при достижении очень высоких положительных значений потенциала. Искровой пробой анодной пленки на титане в 0,1н H2SO4 наблюдается при достижении потенциала около 150 В [3].
Чем выше концентрация кислоты и температура раствора, тем при более положительном потенциале достигается состояние полного закрытия поверхности титана пассивной пленкой, когда титан находится в полностью пассивном состоянии и скорость его анодного растворения не зависит от потенциала [3].
В растворах серной кислоты в присутствии различных катионов: Cu2+, Pt4+, Au3+, Te3+, Al3+ коррозия титана резко снижается по сравнению с коррозией в растворах, не содержащих перечисленных ионов. Замедление скорости коррозии объясняется адсорбцией поверхностью титана этих ионов с последующей их частичной хемосорбцией [4].
Оксидная пленка, образующаяся на титане при анодной поляризации, обладает низкой проводимостью, вследствие чего уже при небольших токах возникают очень высокие значения электродных потенциалов. Чем положительнее электродный потенциал, тем толще пленки. При значениях потенциала более +4 В увеличение толщины пленки практически не происходит. При анодном окислении титана в 40 % серной кислоте пассивная пленка состоит из тонкого внутреннего сплошного слоя (барьерного) δ = 20÷10 Å и внешнего более толстого, но менее сплошного оксидного слоя. Торможение анодного процесса на титане определяется не общей толщиной пассивной пленки, а ее барьерным слоем, в первую очередь затруднением, которое он оказывает протеканию ионного тока в анодном направлении, что связано с уровнем дефектности и полупроводниковыми свойствами барьерного слоя. Дефектность пленок снижается с ростом потенциала до некоторого значения (φ = 1,4В), после чего меняется несущественно [5]. Оксид титана (3) является полупроводником p-типа, а оксид титана (4) – n-типа. Стехиометрия оксидов, тип проводимости, а отсюда их электропроводность и электрохимическая активность зависят от состава раствора, плотности тока и времени поляризации. При анодной поляризации полупроводник p-типа переходит в n-типа [5].
Исследуемые материалы, методики подготовки поверхности, исследований и контроля изложены в работах [6, 7].
Результаты исследования и их обсуждение
Состав исследуемого раствора, полученного после выщелачивания гальваношламов: Fe – 2600 мг/л, Ni – 8,0 мг/л, Cu – 12500 мг/л, Cr – 22,0 мг/л, Zn – 1080 мг/л, Pb – 5,0 мг/л, Sn – 60,0 мг/л, Mn – 15,0 мг/л, Сd – 1,2 мг/л, Co – 1,44 мг/л.
В анионный состав исследуемого раствора входят сульфат, нитрат и хлорид ионы. Redox потенциалы в контрольном и исследуемом растворах равны соответственно +0,81 В и +0,71 В. В исследуемом растворе присутствуют ионы железа, хрома и марганца, имеющие переменную валентность, и redox потенциал в этом растворе устанавливается благодаря их окислительно-восстановительным реакциям.
Об электрохимической анодной активности веществ, присутствующих в исследуемом растворе, судили по поляризационным потенциодинамическим кривым, снятым на платине. В исследуемом растворе ток в два раза выше, чем в контрольном, что говорит об участии примесных ионов в анодных процессах.
Выделение кислорода из исследуемого раствора протекает с большими затруднениями, чем из контрольного раствора, так как посторонние катионы, адсорбируясь на платине, меняют строение ДЭС и тормозят процесс выделения кислорода [5].
Как исходные элементы, так и продукты их электрохимических превращений могут оказывать влияние на формирование оксидной пленки на титане, изменяя ее характеристики. Возможность такого участия была проверена при потенциодинамической анодной поляризации титана до видимого выделения кислорода (основного процесса при электролизе). Несмотря на очень высокое перенапряжение выделения кислорода на платине величина потенциала на титане значительно положительнее, чем на платине (рис. 1).
Это свидетельствует о значительном вкладе в измеряемую величину потенциала падения напряжения в оксидной пленке на титане. Видимое выделение кислорода на титане по сравнению с платиной начинается при более электроположительных потенциалах (3,3–3,4 В) вследствие образования малоэлектропроводной пленки на поверхности титана, состоящей из ряда его оксидов, которые соответствуют Ti2O3 и Ti3O5, что косвенно подтверждает фиолетовый цвет титана после анодной поляризации.
Потенциалы на кривых, снятых гальваностатическим методом, при сравнимых плотностях тока более положительны, чем потенциалы на кривых, снятых потенциодинамическим методом (при 0,3 мА/см2, соответственно 6,0 и 1,0 В). Это увеличение связано с разным временем для формирования малоэлектропроводных пленок оксидов титана, поэтому увеличивается их сопротивление и доля падения напряжения в величине потенциала.
С ростом плотности тока сопротивление на границе электрод – раствор, рассчитанное по величине спада потенциала при отключении тока, снижается (табл. 1).
Таблица 1
Влияние анодной плотности тока на сопротивление границы монолитный титановый электрод – раствор
|
Плотность тока, А/дм2 |
Сопротивление, Ом/дм2 |
|
0,01 |
42,1 |
|
0,02 |
19,6 |
|
0,03 |
15 |
|
0,04 |
11 |
|
0,085 |
8,7 |
|
0,2 |
5,3 |
|
0,45 |
3,2 |
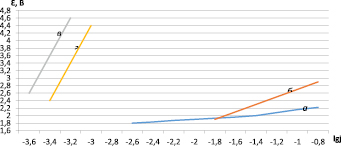
а) на платине в контрольном растворе б) на платине в исследуемом растворе
Рис. 1. Перенапряжение выделения кислорода
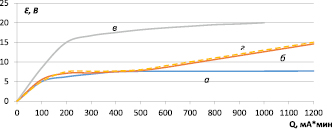
а) 0,085 А/дм2 б) 0,2 А/дм2
Рис. 2. Анодные гальваностатические кривые на монолитном титане
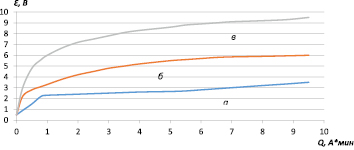
а) 0,45 А/дм2 б) 0,8 А/дм2 в) 2,8 А/дм2
Рис. 3. Анодная поляризация порошкового титана в исследуемом растворе
Увеличение плотности тока приводит к большему локальному разогреву электрода, поэтому пленки будут более дефектными, т.е. с меньшим сопротивлением. Дефектность растет и благодаря повышению степени окисленности титана до ТiO2, чему способствует рост потенциала при увеличении плотности тока. В диапазоне плотностей тока 0,01–0,04 А/дм2 основным процессом является окисление титана, но такие плотности тока невыгодны с точки зрения расхода дефицитного титана. Процесс выделения кислорода протекает неинтенсивно, что тормозит регенерацию серной кислоты при электролизе исследуемого раствора. При плотностях тока 0,085–0,45А/дм2 основной процесс – выделение кислорода, сопротивление границы электрод-раствор оставалось значительным и продолжало уменьшаться с ростом плотности тока.
При длительной гальваностатической поляризации (что характерно для промышленного электролиза) наблюдают два участка изменения потенциала анода (рис. 2).
На первом – значительный рост потенциалов, обусловленный формированием и ростом толщины оксидной пленки на титане. На втором – рост значительно замедляется, на этих участках большая часть тока тратится на выделение кислорода. Непропорционально низкие значения величин потенциалов при больших плотностях тока по сравнению с 0,085 А/дм2 на вторых участках (200–500 мА*мин) свидетельствуют о том, что формируются разные по природе и толщине оксидные слои на титане.
Такая возможность подтверждается тем, что цвет образцов после анодной поляризации в исследуемом растворе при плотности тока 0,45 А/дм2 и 0,2 А/дм2 был светло-серым, что больше соответствует TiO2, а при плотности тока 0,085 А/дм2 – фиолетовым, что характерно для Ti2O3. На основании установленного влияния плотности тока (рис. 3) было предложено снижение последней, что достигалось использованием пористых титановых основ, фактическая поверхность которых в десятки (сотни) раз превышает видимую геометрическую.
Потенциал порошкового титанового электрода, несмотря на большее сопротивление (табл. 2), достигает 3,5 В, тогда как на монолитном – почти 30 В [7] при сравнимых плотностях тока. Уменьшение потенциала достигнуто за счет снижения поляризации электродных процессов при снижении анодной плотности тока и формировании иных по природе оксидных слоев, на которых менее затруднено выделение кислорода.
Потенциодинамическое исследование пористого титанового электрода показало, что на нем выделение кислорода из исследуемого раствора (как и на монолитном (рис. 1) облегчено по сравнению с контрольным раствором. Влияние элементов, находящихся в исследуемом растворе, на процессы, протекающие на пористом титановом электроде, выражено гораздо меньше, чем на монолитном титане. При одинаковых плотностях тока (на геометрическую поверхность электрода) потенциалы монолитного и пористого электрода в гальваностатическом режиме были более положительны, чем в потенциодинамическом режиме. Разница потенциалов на пористом титане составляет ≈ 0,8 В, тогда как на монолитном ≈ 4 В.
Определено сопротивление границ пористого титана в исследуемом растворе при плотностях тока 0,8 и 2,8 А/дм2 (табл. 2).
Таблица 2
Влияние анодной плотности тока на сопротивление границы пористый электрод – раствор
|
Плотность тока, А/дм2 |
Сопротивление, Ом/дм2 |
|
0,45 |
1 |
|
0,8 |
0,33 |
|
2,8 |
0,2 |
Сопротивление на границе пористый титан – раствор в 3,2 раза ниже, чем сопротивление на границе монолитный титан-раствор (табл. 1) и тоже уменьшается с ростом плотности тока. Видимое выделение кислорода на пористом титане зафиксировано при потенциале 2,4 В, т.е. практически с самого начала опыта.
С ростом плотности тока на пористом титане так же, как и на монолитном, наблюдается рост потенциала, что связано с формированием на титане фазовой оксидной пленки с более защитными свойствами. Цвет электродов после анодной поляризации при плотности тока 0,45 А/дм2 и 0,8 А/дм2 был золотисто-бронзовый, а при плотности тока 2,8 А/дм2 – фиолетовый, что соответствует TiO и Ti2O3.
Выводы
1. Полученные результаты свидетельствуют о том, что наибольший вклад в измеряемую величину потенциала вносит омическое падение напряжения в пленке, состоящей из смеси оксидов титана, имеющих полупроводниковую природу.
2. В процессе анодной поляризации на пористом электроде величина потенциала в 5 раз меньше, чем на монолитном. Пористые титановые основы и рекомендуются для нанесения активного слоя.
Библиографическая ссылка
Бачаев А.А., Пачурин Г.В., Смирнова В.М., Иванова О.М. ХАРАКТЕРИСТИКИ ТИТАНОВЫХ ОСНОВ ДЛЯ КОМПОЗИЦИОННЫХ АНОДОВ В УСЛОВИЯХ РЕГЕНЕРАЦИИ ОТРАБОТАННЫХ СЕРНОКИСЛЫХ ЭЛЕКТРОЛИТОВ // Международный журнал прикладных и фундаментальных исследований. – 2018. – № 2. – С. 76-80;URL: https://applied-research.ru/ru/article/view?id=12111 (дата обращения: 18.04.2024).

