Хмель обыкновенный – (Humulus lupulus L.) – вид травянистых многолетних двудомных растений рода Хмель (Humulus) с хромосомным определением пола. Мужские растения имеют кариотип 2n = 18 + XY , женские – 2n = 18 + ХХ [1,2]. Хмель промышленно культивируется на плантациях. Получаемое сырье, а именно соплодия хмеля (так называемые «шишки») применяют в пивоварении, производстве некоторых сортов хлеба, эфирные масла и экстракты хмеля входят в состав некоторых лекарственных препаратов [3, 4]. Хозяйственной ценностью обладают только женские растения. Морфологически при обычных условиях культивирования пол хмеля проявляется только через 2–3 года после прорастания, всё это время малоценные мужские растения требуют ресурсов на свое поддержание, занимают на плантации место и к моменту идентификации пола уже обладают развитой корневой системой, что влечет затраты на их корчевание. В связи с этим важное значение имеет разработка способов быстрого и раннего определения пола, в частности основанных на молекулярных маркерах. Изучение последовательностей половых хромосом также может пролить свет и на некоторые фундаментальные вопросы, связанные с происхождением и функционированием половых хромосом. В частности, ранее цитогенетически показано, что X и Y-хромосомы хмеля в мейозе образуют бивалент [5], что подразумевает наличие в них гомологичных (псевдоаутосомных) районов. В нашей работе показано наличие районов гомологии между фрагментами Y-хромосомы и фрагментами ДНК из женских растений.
В результате изучения механизмов определения пола хмеля обыкновенного были созданы цитогенетические методы определения пола [1, 2]. Использование этих методик, однако, сопряжено с рядом неудобств. Митотические хромосомы хмеля плохо различимы, а наблюдение мейотических хромосом бессмысленно, так как возможно не ранее первого цветения растений, когда их пол будет уже и так очевиден. Кроме того, методика цитогенетических исследований трудоемка и требует специалистов соответствующего уровня. Для хмеля японского был разработан субтеломерный маркер для in situ гибридизации [6], однако набор половых хромосом японского хмеля отличается от набора половых хромосом хмеля обыкновенного, что делает этот маркер неприменимым для хмеля обыкновенного. Позднее появились тест-системы, основанные на ПЦР с Y-специфичной мишенью. Основной проблемой разработки подобных систем является малое количество Y-специфичных последовательностей в открытом доступе. Яковин с соавт. [7] произвели лазерную микродиссекцию полового бивалента с созданием библиотеки полоспецифичных ДНК-фрагментов, однако работа выполнена на другом виде хмеля (хмеле японском Humulus japonicus), у которого система детерминации пола отличается от таковой у хмеля обыкновенного. Появление геномных сиквенсов хмеля обыкновенного [8] не улучшило ситуацию, так как в этой работе были отсеквенированы женские растения. Polley с соавторами создал на основе RAPD-маркера OPJ-09 ПЦР-тест-систему [9] с обнаруженной Y-специфичной мишенью. Данная тест-система успешно применялась для научных исследований [10]. Gao с соавторами также пытались применить RAPD-маркер для полоидентификации у Humulus scandens L. [11]. Однако для массового рутинного применения использование ПЦР-тест-систем в классическом варианте (с детекцией результатов с помощью агарозного электрофореза) нежелательно из-за высокого риска развития контаминации реактивов и пластика ПЦР-продуктами, поэтому нами на основе маркера OPJ-09 была разработана новая тест-система на основе ПЦР в режиме реального времени (ПЦР-РВ), лишенная данных недостатков. Кроме того, произведена попытка создать ПЦР-РВ-тест-систему на основе фрагмента AJ831218.1 [12].
Цель исследования: изучение последовательности опубликованных молекулярных маркеров для определения пола у хмеля обыкновенного, а также разработка тест-системы для ПЦР-РВ на их основе.
Материалы и методы исследования
В работе использовались 5 образцов растений хмеля обыкновенного (Humulus lupulus L.) известного пола – 2 женских (№ 1, 2) растения и 3 мужских (№ 3, 4, 5). Эти образцы собрали в районе д. Корж (Псковская область) с пяти взрослых растений в фазе цветения. Пол определен по строению генеративных органов. Определение вида (H. lupulus) произведено по ботаническим признакам. Образцы листьев этих растений высушили и транспортировали при комнатной температуре. Кроме того, в работе использовали 8 растений неизвестного пола. Растения получены в виде семян, пророщены и укоренены. На момент исследования эти растения ещё не сформировали генеративных органов. Из них 6 сортовых растений сортов Amarillo (A1, A2, A3), Crystal (C1 и С2) и Nugget (N). ДНК этих растений выделяли из свежих листьев. Выделение ДНК производилось CTAB-методом (Doyle and Doyle, цит. по [13]).
В работе использовали праймеры STS, подобранные Polley с соавт. на основе RAPD-маркера OPJ09 [9]. Праймеры ITS [12] (универсальные праймеры на кластеры рибосомных генов растений и грибов) использовали для проверки пригодности ДНК к ПЦР, чтобы исключить ложноотрицательные результаты, которые могут быть вызваны недостаточным качеством ДНК, что при выделении ДНК из растений наблюдается нередко. Кроме того, нами произведен подбор праймеров для ПЦР-РВ на основе последовательности AJ831218.1 из работы по поиску полоспецифичных маркеров для хмеля обыкновенного [12].
Постановка ПЦР производилась в пробирках объемом 600 мкл, объем реакционной смеси – 20 мкл на пробирку. Состав реакционной смеси для ПЦР с праймерами STS [9] и ITS: 1х буфер для Taq-полимеразы, 2,5 мМ магния хлорид, 0,125 мМ трифосфаты нуклеотидов 0,25мкМ праймер прямой, 0,25 мкМ праймер обратный, 0,125 е.а./мкл Taq-полимераза, 0,2 % БСА. Состав реакционной смеси для ПЦР-РВ: 1х буфер для Taq-полимеразы, 2,5 мМ магния хлорид, 0,125 мМ трифосфаты нуклеотидов 0,25 мкМ праймер прямой, 0,25 мкМ праймер обратный, 0,125 мкМ зонд, 0,125 е.а./мкл Taq-полимераза, 0,2 % БСА.
Использовали праймеры STS (STSF: ACAGAGTACAACTCAG-AAACAAACC, STSR: AAGGTCGCACAATGACCG) [9], ITS (ITS4:TCCTCCGCTTATTGATATGC, ITS5: GGAAGTAAAAGTCGTAACAAG). [14]. HLRTF TTGGCCGTCCTCTCTATCGTA HLRTR: CCCTATTTGTGGCTGGTGTAAT HLRTPR: FAM-TCATGTGAGTGGAGAAAAACCCTAATCC-BHQ1 HLRT2F: CTATGCCAACTTGAAGAGGGAT, HLRT2R: ACCTTCCTGACTCCAACGTAGA, HLRT2Pr: FAM- TATGAAACACTTCTCTTTTAAGGTGGTGCC- BHQ1.
Реакцию с праймерами STS проводили по программе: начальная денатурация – 94 °С (5 мин), далее 45 циклов: 94 °С (15 с), 54 °С (30 с), 72 °С (60 с), финальная элонгация – 72 °С (5 мин). Реакцию с праймерами ITS4/5 проводили по программе: начальная денатурация – 94 °С (5 мин), далее 40 циклов: 94 °С (5 с), 55 °С (30 с), 72 °С (40 с), финальная элонгация – 72 °С (5 мин). Анализ результатов ПЦР произведен методом электрофореза в агарозном геле. Продукты ПЦР-реакции с праймерами STS были секвенированы. Подбор праймеров и зондов для ПЦР в режиме реального времени на основе полученных сиквенсов производился вручную в программе Vector NTI (Invitrogen). Анализ сиквенса производился путем поиска гомологичных последовательностей с помощью базы данных NCBI. Реакцию с праймерами для ПЦР-РВ ставили в приборе АНК-32 (ИАП, Санкт-Петербург) по программе: начальная денатурация – 95 °С (3 мин), далее 40 циклов: 95 °С (15 с), 60 °С (30 с), 72 °С (30 с) с детекцией флюоресценции по каналу 1.
Результаты исследования и их обсуждение
Произвели выделение ДНК c получением 13 препаратов тотальной ДНК, их ПЦР-пригодность определили с помощью реакции с праймерами «ITS4-ITS5», которая успешно прошла на всех образцах (рис. 1).
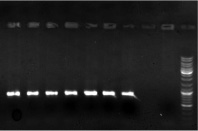
Рис. 1. Результат реакции с праймерами ITS4-ITS5 для проверки пригодности выделенной ДНК к ПЦР (первые 7 образцов). Вторая и третья дорожка справа – отрицательные контроли, первая дорожка справа – маркер молекулярного веса (Gene Ruler DNA Ladder Mix (Fermentas))
На всех образцах была поставлена ПЦР с праймерами STS [9] В результате постановки ПЦР на растениях известного пола был получен положительный результат: ПЦР-продукт ожидаемой длины (~1100 п.н.) на ДНК из растений мужского пола и отсутствие этого продукта у растений женского пола (рис. 2, а).
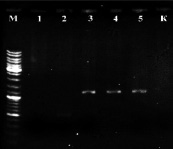
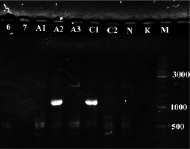
а) б)
Рис. 2. а) Результат ПЦР с праймерами STS пяти образцов растений известного пола: женского (1, 2) и мужского (3, 4, 5). К – отрицательный контроль, М – маркер молекулярного веса (Gene Ruler DNA Ladder Mix (Fermentas)); б) Определение пола у 8 экземпляров H. lupulus с помощью ПЦР с праймерами STS. A-Amarillo, C-Crystal, N-Nugget. Растения А2 и С1 – мужские. К – отрицательный контроль, М – маркер молекулярного веса (Gene Ruler DNA Ladder Mix (Fermentas))
Таким образом, с помощью ПЦР на ДНК растений известного пола подтверждена работоспособность данной тест-системы и целевой характер полученных ампликонов. Также с помощью этой системы проверили все остальные растения (рис. 2, б), выявлено два мужских растения (A2 и С1), все остальные исследованные сортовые растения оказались женскими. ПЦР-продукты очистили с помощью препаративного электрофореза в агарозном геле и отсеквенировали по Сенжеру, так как на момент проведения работ сиквенс маркера OPJ-09 из работы [9], опубликованный затем в [15], ещё не был доступен. Сиквенс депонировали в базе данных NCBI (KY348696). Реальная длина фрагмента вместе с праймерами оказалась равна 1116 п.н. (рис. 3). Произвели изучение отсеквенированного фрагмента с помощью поиска гомологии в базе данных нуклеотидных последовательностей NCBI. Ввиду наличия в доступе черновых вариантов геномного сиквенса хмеля обыкновенного [8] они также были задействованы. Для геномного секвенирования в работе [8] использовались женские растения, поэтому эти сиквенсы не могут содержать Y-хромосомные последовательности. Однако оказалось, что более половины сиквенса ПЦР-продукта с праймеров STS представлены районом, гомологичным каким-то другим хромосомам хмеля. Каким именно (X-хромосоме или аутосомам), к сожалению, сказать нельзя, так как данные геномного секвенирования в работе [8] являются предварительными и хромосомная принадлежность собранных сиквенсов не определена. Район гомологии начинается от 450 нуклеотида и продолжается вплоть до праймера STSR (рис. 3). Алгоритм поиска обнаруживает в геномных сиквенсах хмеля обыкновенного несколько фрагментов (четыре представленных на рис. 3, б, и ещё четыре с более короткими областями гомологии).

Рис. 3. Выравнивание полученного сиквенса фрагмента Y-хромосомы (KY348696) с праймеров STS (а) и контигов, полученных геномным секвенированием женских растений хмеля [8] (б), а также маркера OPJ-09 [9, 15] (в). Показано положение праймеров STS и компонентов тест-системы для ПЦР-РВ)
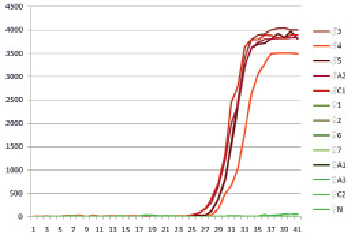
Рис. 4. Результат испытания тест-системы HLRT2 на ДНК растений H. lupulus. Виден рост интенсивности флюоресценции при постановке реакции с ДНК мужских растений
Идентичность этих последовательностей довольно высока и варьирует от 94 до 97 %. По всей видимости, фрагмент, заключенный между STS-праймерами, весьма консервативен, так как полученный нами сиквенс (KY348696) совпадает с опубликованным в [15] сиквенсом маркера OPJ-09 (KX688593.1) почти полностью за исключением трех однонуклеотидных замен. Кроме указанных на рис. 3 последовательностей, обнаружено также несколько более коротких Интересно, что для остальной части сиквенса KY348696 (не гомологичной другим хромосомам хмеля) не удается найти никаких аннотированных гомологичных последовательностей.
Очевидно, что для конструирования тест-системы для ПЦР-РВ ввиду выявленного для части фрагмента отсутствия полоспецифичности пригодна только часть, прилегающая к праймеру STSF. С учетом данного требования нами была сконструирована диагностическая тест-система HLRT2, предназначенная для ПЦР-РВ и состоящая из праймеров HLRT2F, HLRT2R и флюоресцентно меченного зонда HLRT2Pr с красителем FAM и гасителем BHQ1. Тест-система HLRT2 сработала корректно, дав положительный сигнал на всех образцах мужской ДНК и отсутствие положительного сигнала на ДНК женских растений (рис. 4). Результаты работы тест-системы HLRT2 полностью совпадают с результатами работы тест-системы STS. Таким образом, нами разработана тест-система на основе ПЦР-РВ, пригодная для определения пола у хмеля.
Попытки создания тест-системы на основе сиквенса AJ831218.1 [12] с праймерами HLRTF, HLRTR и HLRTPr не увенчались успехом – разработанная тест-система срабатывала на ДНК всех использованных в работе растений, вне зависимости от их пола. По результатам анализа последовательности AJ831218.1 с помощью выравнивания с геномной ДНК H. lupulus обнаружили похожую с KY348696, но ещё более выраженную картину – почти весь сиквенс (304 п.н. из 471) высокоидентичен последовательностям ДНК из женского растения, что объясняет неудачу с изготовлением ПЦР-РВ-тест-системы на базе данного маркера. При этом в данном случае обнаруживается более сорока контигов, содержащих более или менее протяженные области гомологии с AJ831218.1, что может свидетельствовать о высокой копийности данной последовательности.
Выводы
На основе полученного сиквенса нами разработана новая тест-система на основе метода ПЦР в режиме реального времени, которая была испытана на разных растениях различных сортов и показала свою работоспособность. При анализе последовательностей молекулярных маркеров дляопределения пола у H. lupulus с помощью выравнивания на черновой вариант геномного сиквенса женского растения H. lupulus обнаружены области почти полной гомологии с фрагментом хромосом женского растения. В частности, не исключено, что полученный нами сиквенс захватывает границу псевдоаутосомного региона Y-хромосомы.
Авторы работы выражают искреннюю благодарность к.б.н. Д.Е. Полеву за помощь в получении семенного материала и к.б.н. Е.А. Андреевой за всестороннюю помощь и поддержку.
Библиографическая ссылка
Богомаз О.Д., Владимиров И.А., Павлова О.А., Богомаз Д.И. ИЗУЧЕНИЕ ПОЛОСПЕЦИФИЧНЫХ МАРКЕРОВ ХМЕЛЯ ОБЫКНОВЕННОГО (HUMULUS LUPULUS L.) И РАЗРАБОТКА НОВОГО МАРКЕРА ДЛЯ ОПРЕДЕЛЕНИЯ ПОЛА // Международный журнал прикладных и фундаментальных исследований. – 2019. – № 4. – С. 151-155;URL: https://applied-research.ru/ru/article/view?id=12714 (дата обращения: 20.04.2024).

