Болезнь Альцгеймера (БА) является в настоящее время одной из наиболее распространенных форм деменции. Это неизлечимое на сегодняшний день дегенеративное заболевание поражает людей старше 60–65 лет.
Впервые эта форма деменции – нейродегенеративное заболевание было описано в 1907 г. немецким психиатром Алонсом Альцгеймером. По современным статистическим данным, в настоящее время число больных БА достигает в среднем 26,6 млн чел., однако ученые предполагают, что число больных может увеличиться к 2050 г. до 106,6 млн людей (т.е. практически в 4 раза). БА характеризуется расстройством памяти, нарушениями афазии, нарушением способности больного ориентироваться в окружающей его обстановке [1]. Отмечаются большие нарушения многих когнитивных функций пациента. Болезнь обычно длится около 7 лет. В современной литературе накоплено большое число работ, показывающих изменение строения мозга при болезни Альцгеймера [2–4]. Большое внимание в литературе концентрируется на роль глии при БА [5–7]. В литературе обсуждается вопрос о генетической предрасположенности людей к БА [8–10].
Большим аспектом является изучение экспериментальных моделей БА, этому вопросу посвящены работы большого количества научных коллективов [11].
Цель исследования: изучение особенностей структурной организации корковых полей мозга у пациентов с БА.
Материалы и методы исследования
Проводилось исследование цитоархитектонического строения корковых формаций мозга 12 пациентов с БА в сопоставлении с цитоархитектоническим строением корковых формаций мозга 12 людей, не страдавших психическими заболеваниями. Всего было исследовано 48 полушарий мозга (табл. 1, 2).
Была изучена цитоархитектоника коркового поля 4 двигательной области, полей 44 и 45 зоны Брока лобной области, поля 39 нижней теменной области мозга и гиппокампа. Срезы были окрашены крезилом фиолетовым по методу Ниссля, а также по методу Бильшовского и Гольджи. Толщина срезов 20 мкм, изучался каждый 40-й срез, всего было изучено 12000 срезов. Взятие материала осуществлялось в течении 24 ч после смерти, мозг фиксировался в растворе 10 % нейтрального формалина. Мозги пациентов с болезнью Альцгеймера были представлены из патологоанатомического отделения Научного центра психического здоровья.
В работе применялись современные морфометрические методы для определения толщины коры и толщины отдельных цитоархитектонических слоёв, измерения площади профильного поля нейронов, исследования плотности нейронов и глии. Значимость отличий определялась с использованием t-критерия Стьюдента.
Таблица 1
Возраст и причина смерти людей контрольной группы
|
№ |
Возраст |
Пол |
Вес мозга |
Причина смерти |
|
1. |
55 |
м |
1440 |
Сепсис |
|
2. |
55 |
м |
1340 |
Инсульт |
|
3. |
57 |
ж |
1380 |
Инсульт |
|
4. |
59 |
м |
1435 |
Острая сердечная недостаточность |
|
5. |
60 |
м |
1580 |
Травма |
|
6. |
62 |
м |
1567 |
Острая сердечная недостаточность |
|
7. |
68 |
м |
1420 |
Острая сердечная недостаточность |
|
8. |
78 |
м |
1250 |
Сердечно-легочная недостаточность |
|
9. |
77 |
м |
1220 |
Острая сердечная недостаточность |
|
10. |
78 |
м |
1372 |
Рак желудка |
|
11. |
80 |
м |
1522 |
Острая сердечная недостаточность |
|
12. |
84 |
м |
1410 |
Перитонит |
Таблица 2
Возраст и причина смерти пациентов с болезнью Альцгеймера
|
№ |
Возраст |
Пол |
Вес мозга |
Начало болезни (возраст) |
Продолжительность болезни |
Причина смерти |
|
1 |
55 |
ж |
1100 |
51 |
4 |
Тромбоэмболия легочной артерии |
|
2 |
64 |
м |
1050 |
57 |
7 |
Пневмония |
|
3 |
67 |
ж |
1190 |
62 |
5 |
Сердечная недостаточность |
|
4 |
71 |
ж |
1000 |
64 |
7 |
Тромбоэмболия легочной артерии |
|
5 |
71 |
ж |
1070 |
67 |
4 |
Тромбоэмболия легочной артерии |
|
6 |
74 |
ж |
960 |
69 |
5 |
Отек легкого |
|
7 |
74 |
ж |
1080 |
70 |
4 |
Сердечная недостаточность |
|
8 |
75 |
ж |
960 |
60 |
15 |
Острая сердечная недостаточность |
|
9 |
78 |
ж |
1030 |
72 |
6 |
Гангрена |
|
10 |
82 |
ж |
1060 |
79 |
3 |
Острая сердечная недостаточность |
|
11 |
82 |
ж |
1100 |
77 |
5 |
Тромбоэмболия легочной артерии |
|
12 |
83 |
ж |
890 |
82 |
1 |
Пневмония |
Результаты исследования и их обсуждение
Сравнительный анализ веса мозга пациентов с БА и мозга людей, не страдающих психическими и неврологическими заболеваниями, выявил резкое снижение веса мозга при БА. У людей без психических заболеваний вес мозга в возрасте от 55 лет до 78 лет в среднем равнялся 1411 г. У больных с БА в возрасте от 55 лет до 83 лет вес мозга снижался до 1041 г. Вес самого маленького мозга у больной 83 лет с БА равнялся 890 гр. Такое резкое снижение веса мозга у пациентов с БА может быть, по нашему мнению, с одной стороны, результатом атрофических процессов в корковых и подкорковых образованиях мозга, а с другой стороны, результатом нарушения развития мозга уже в пренатальном и постнатальном онтогенезе. Большое значение, по-видимому, имеет индивидуальная вариабельность строения мозга человека [12].
Выявляется резкое изменение макроскопии мозга больных БА: значительно расширяются борозды мозга и уменьшаются извилины мозга. Мозг по своей форме напоминает «грецкий орех».
В результате проведенных исследований во всех мозгах пациентов с болезнью Альцгеймера были выявлены тангеллы. Тангеллы различались по форме и размерам. Тангеллы располагались в основном в цитоархитектоническом слое II–III изученных корковых полей пациентов с БА (рис. 1).
Наряду с появлением тангелл, в мозге больных с БА выявляется большое число амилоидных бляшек. Наибольшее число амилоидных бляшек локализуется в гиппокампе, височной области и лобной области мозга больных (рис. 2).
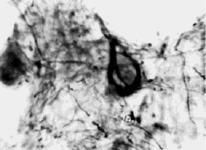
Рис. 1. Локализация тангелл в слое III коры поля 45 мозга пациента с болезнью Альцгеймера. Окраска по Бильшовскому, об. х100, ок. х10
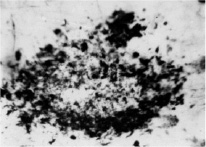
Рис. 2. Амилоидная бляшка в слое III коры поля 45 мозга пациента с болезнью Альцгеймера. Окраска по Бильшовскому, об. х100, ок. х10
В результате проведенного исследования было также установлено резкое изменение сосудов мозгов и локализация амилоидных бляшек и астроцитов около сосудов (рис. 3).
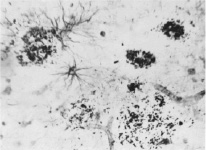
Рис. 3. Локализация амилоидных бляшек и астроцитов около сосудов в слое III коры поля 44 мозга пациента с болезнью Альцгеймера. Окраска по Бильшовскому, об. х100, ок. х10
При изучении корковых полей мозга пациентов с БА была выявлено уменьшение ширины коры мозга. Так, например, в норме ширина коры поля 44 речедвигательной зоны Брока достигается 2,5 мм, а при БА – только 1,94–1,97 мм. Ширина коры поля 39 у здоровых людей в среднем равняется 3,04 ± 0,6, а при БА 2,26 ± 0,7 мм (рис. 4).
Резко уменьшается ширина отдельных цитоархитектонических слоев корковых формаций мозга при БА, так, в поле 39 теменной области коры наиболее ярко наблюдается уменьшение ширины коры цитоархитектонических слоев II, III1, III2.
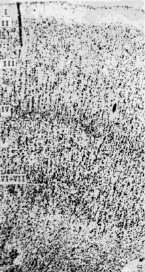
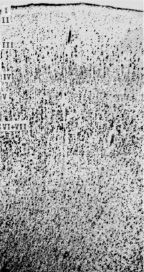
Норма Болезнь Альцгеймера
Рис. 4. Цитоархитектоника коры поля 39 в норме и при болезни Альцгеймера. Окраска крезилом фиолетовым по методу Ниссля, об. х2,5, ок. х40
Так, у здоровых людей ширина цитоархитектонического слоя I поля 39 равняется 0,24 мм, а при БА – 0,16 мм, то есть уменьшается в 1,5 раза. Ширина слоя II поля 39 у здоровых людей равняется 0,14 мм, а при БА – 0,8 мм, то есть уменьшается почти в 2 раза.
Ширина цитоархитектонического слоя VI поля 39 у здоровых людей равняется 1,01 мм, при БА 0,66 мм, то есть уменьшается почти в 1,5 раза. Цитоархитектонические слои нижнего этажа поля 39 при БА уменьшаются по ширине меньше, чем цитоархитектонические слои верхнего этажа коры. Так, ширина цитоархитектонического слоя IV поля 39 мозга здоровых людей равняется 0,30 мм, а при БА – 0,28 мм. В поле 39 ширина слоя V мозга здоровых людей достигает 0,45 мм, а при БА – 0,34 мм, ширина слоев VI–VII коры мозга равняется 0,89 мм, а при БА-0,75 мм.
Плотность нейронов в корковых полях мозга при болезни БА значительно уменьшается, так, в слоях II, III1, III2 показатель плотности нейронов при БА уменьшается почти в 2 раза.
Так, в цитоархитектоническом слое III коры поля 39 париетальной области мозга плотность нейронов коры при БА уменьшается до 59 % до 60 %, причем особенно страдают верхние подслои цитоархитектонического слоя III поля 39 коры мозга при БА, так, плотность нейронов в подслое III2 падает на 79–80 %, и в подслое III2 цитоархитектонического слоя III на 60 %, а в подслое III2 слоя III поля 39 – только на 26–30 %. В цитоархитектоническом слое IV поля 39 при БА изменения плотности нейронов минимальные, а в цитоархитектоническом слое V поля 39 париетальной области коры мозга при БА уменьшается на 34–35 %, и в слоях VI–VII – на 32–33 % по сравнению с теми же слоями поля 39 здоровых людей.
Профильное поле пирамидных нейронов в корковых формациях мозга при БА значительно уменьшается по сравнению с теми же нейронами корковых формаций здоровых индивидуумов. Так, профильное поле пирамидных нейронов в слое III поля 39 париетальной области мозга здоровых людей равняется в среднем 226 ± 10,1 мкм2, в то время как размеры тех же самых нейронов поля 39 при БА уменьшается до 186 ± 7,0 мкм2.
При БА резко изменяется нейронный состав цитоархитектонических слоев корковых полей мозга: так, в норме число крупных нейронов в слое III2 поля 39 составляет 20 %, то в том же слое поля 39 при БА число крупных нейронов уменьшается вдвое и достигает только 10 %, число мелких нейронов в норме в слое III2 составляет 24 %, а при БА – 45 %.
Результаты исследования показали значительное уменьшение веса мозга людей при БА. Такую же тенденцию уменьшения веса мозга при БА наблюдали с помощью МРТ [13]. МРТ-исследования, проводимые авторами, позволили использовать этот метод для большого количества пациентов с БА, которые различались по началу и протяженности болезни. Авторами были также показаны определенные различия веса мозга у разных индивидуумов при БА. Потеря веса мозга у людей с БА может быть одной из причин развития нарушений когнитивных функций. Ряд авторов показали на основе МРТ-исслледований резкие изменения не только всего мозга, но и отдельных структур мозга, таких как, например, гиппокампа и желудочков.
Как показали наши исследования, толщина коры отдельных цитоархитектонических полей мозга пациентов с БА, так же значительно уменьшается, причем наиболее значительное уменьшение толщины коры мозга наблюдается во фронтальной и темпоральной областях коры мозга. Нами было так же установлено резкое уменьшение плотности нейронов в корковых формациях пациентов с БА, особенно в слоях II и III.
Проведенные исследования показали, что при БА отмечается значительное уменьшение размеров профильного поля пирамидных нейронов крупных и средних размеров. Рядом авторов было отмечено, что при БА уменьшается число дендритов, нарушается стратификация цитоархитектонических слоёв, уменьшается число синапсов.
При БА в мозге накапливается большое количество токсичного белка – бета-амилоида, причем наиболее сильно страдает гиппокамп, который отвечает за память и ориентацию в пространстве [14], а большие изменения нейронного состава в слое III коры ассоциативных полей мозга людей с БА приводят к нарушению аналитико-синтетической функции корковых полей мозга.
Заключение
В результате проведенного исследования мы выявили, что при БА ассоциативные корковые поля характеризуются большим числом тангелов, расположенных в слоях II и III коры мозга. В слоях VI–VII число тангелов значительно меньше по сравнению с вышерасположенными цитоархитектоническими слоями. Также установлена большая индивидуальная вариабельность поражения корковых формаций мозга людей с БА, что может быть связано с особенностями начала болезни, тяжестью начла заболевания и её продолжительностью.
Библиографическая ссылка
Боголепова И.Н., Малофеева Л.И., Агапов П.А., Малофеева И.Г., Свешников А.В. СТРУКТУРНЫЕ ИЗМЕНЕНИЯ КОРКОВЫХ ФОРМАЦИЙ МОЗГА ЧЕЛОВЕКА ПРИ БОЛЕЗНИ АЛЬЦГЕЙМЕРА // Международный журнал прикладных и фундаментальных исследований. – 2019. – № 6. – С. 9-13;URL: https://applied-research.ru/ru/article/view?id=12758 (дата обращения: 17.04.2024).

