Микроглиоциты – это особая разновидность тканевых макрофагов, характерных для органов нервной системы [1]. Научный интерес к изучению различных аспектов организации и функционирования микроглии центральной нервной системы неуклонно возрастает в связи с открытием новых ее функций. Традиционно микроглию принято рассматривать как ключевой элемент воспалительного процесса, развивающегося в нервной ткани (нейровоспаления) в ответ на повреждающие воздействия [2]. Однако в ряде исследований было показано, что функции микроглии охватывают более широкий круг процессов, напрямую не связанных с развитием реакции на повреждение и инициацией воспаления. В частности, установлено, что микроглия осуществляет постоянный мониторинг состояния синаптических структур нейропиля и является одним из главных регуляторов синаптической пластичности [3, 4], а также служит передовым элементом защитной системы ликвороэнцефалического барьера [5]. Считается, что структура этих клеток неразрывно связана с их функциональным состоянием [6], поэтому изучение морфологических характеристик микроглиоцитов при различных патологических воздействиях может способствовать пониманию их патогенеза.
Согласно современным представлениям микроглия подразделяется на три основных типа: ветвящуюся (рамнифицированную), амебоидную (активированную) и переходную (промежуточную) [7]. При этом, несмотря на многочисленные исследования, посвященные изучению разнообразных свойств и особенностей строения этих клеток в разных отделах головного мозга [8, 9], данные об их структурной организации в мозжечке весьма фрагментарны, а о трансформации микроглии под воздействием такого неблагоприятного фактора, как общий анестетик, – вообще отсутствуют. Вместе с тем мозжечок – центральная структура головного мозга, ответственная за двигательную активность и осуществление когнитивных навыков [10]. Известно, что мозжечок высокочувствителен к повреждающим воздействиям. При всем многообразии повреждающих факторов, токсическое воздействие общих анестетиков занимает особое место, поскольку частота нарушений функций именно мозжечка при общей анестезии чрезвычайно высока [11]. В связи с этим данные о структурных изменениях, происходящих в мозжечке при воздействии общих анестетиков, представляют исключительный интерес.
Цель настоящей работы – морфометрическая оценка структурной организации микроглиоцитов всех слоев коры мозжечка в норме и при токсическом воздействии общего анестетика севофлурана.
Материалы и методы исследования
Работа проведена на крысах-самцах породы Вистар. Животные были поделены на две группы: контрольная («К», n = 8) и экспериментальная («Э», n = 7), в которой крысы подвергались экспозиции общего анестетика севофлурана в течение 6 ч. Все эксперименты in vivo выполнены в соответствии с правилами проведения работ с использованием экспериментальных животных (принципы Европейской конвенции, Страсбург, 1986 г., и Хельсинкской декларация Всемирной медицинской ассоциации о гуманном обращении с животными, 1996 г.).
Для индукции анестезии крыс из группы «Э» помещали в индивидуальные боксы, размещённые в общей камере, подключенной к аппарату для ингаляционной анестезии, оборудованному испарителем «Sevorane» (Abbott Laboratories Ltd., Великобритания), и подавали 8 об % севофлурана (Севоран®; Abbott Laboratories Ltd., Великобритания, № серии 6042404) в потоке воздуха (2 л/мин). Для поддержания анестезии использовали 2 об % севофлурана и поток воздуха 1 л/мин.
На 22 сутки после эксперимента крыс декапитировали и извлекали головной мозг. Материал фиксировали в 10 % нейтральном формалине на фосфатном буфере (рН 7,4) не менее 24 ч. Для получения сопоставимых результатов образцы от всех животных обрабатывали параллельно и в одинаковых условиях.
После формалиновой фиксации из мозга вырезали мозжечок, для морфологического анализа забирали заднюю долю мозжечка. Используя стандартную гистологическую методику со спиртами возрастающей концентрации, материал заливали в парафиновые блоки. Срезы, перпендикулярные извилинам, толщиной 5 мкм готовили с помощью микротома Accu-Cut SRT 200 (Sakura, Япония). Для обзорного исследования препаратов применяли крезиловый фиолетовый (Bio-Optica, Италия).
Микроглиоциты выявляли иммуногистохимически с использованием первичных поликлональных козьих антител к белку Iba-1 (AbCam, Великобритания, по каталогу – ab107159) в разведении 1:2000; экспозиция 45 мин при комнатной температуре. Для связывания первичных антител применяли набор реагентов R.T.U. VECTASTAIN Universal Quick Kit Catalog № РК-7800 (США). Визуализацию продукта реакции проводили при помощи хромогена DAB+ (Diagnostic BioSystems, Нидерланды). Препараты докрашивали гематоксилином Майера (Bio-Optica, Италия).
На препаратах под световым микроскопом DM-750 (Leica, Германия) с помощью компьютерной программы анализа изображений ImageScope M изучали оба полушария мозжечка. На каждом срезе при окуляре×10 и объективе×40 в 20 полях зрения (размер каждого поля 0,33×0,25 мм) подсчитывали количество ядросодержащих микроглиоцитов в молекулярном и ганглионарном слоях (МС и ГС соответственно) и отдельно в зернистом слое (ЗС). У микроглиоцитов определяли диаметр тела, длину и толщину отростков. Статистическую обработку полученных данных проводили с использованием стандартного пакета программ (Statistica 7.0 Stat.Soft for Windows). Вычисляли среднее арифметическое значение и его стандартную ошибку (M ± m), оценку значимости различий показателей проводили с применением критерия Вилкоксона и U-критерия Манна – Уитни. Значимость различий определяли при p < 0,05.
Результаты исследования и их обсуждение
Изучение полученных препаратов из группы К показало, что цитоархитектоника слоёв коры мозжечка не нарушена. Перицеллюлярного и периваскулярного отёка не выявлено. МС представлен мелкими корзинчатыми и звёздчатыми нейронами с перикарионами округлой или полигональной формы, округлыми ядрами с расположенным по центру ядрышком. Они лежат свободно и относительно далеко друг от друга. ГС состоит из одного ряда крупных, грушевидной формы клеток Пуркинье (КП) с большими округлыми ядрами центрально расположенными ядрышками. В ЗС нейроны располагаются в виде плотных тяжей или гнёзд.
У животных, подвергшихся воздействию анестетика, цитоархитектоника слоёв коры мозжечка сохранена. Определяется периваскулярный отёк. В МС выявляется умеренное число морфологически измененных нейронов: сморщенные нейроны без ядра и нейроны с деформированным гиперхромным ядром. В ГС наблюдается выпадение нейронов, большая часть КП морфологически изменены. Перикарион таких нейронов сморщивается, изменяются тинкториальные свойства: контур становится нечёткий, ядра и цитоплазма имеют трудноразличимые границы. В единичных случаях наблюдается эктопия КП в ЗС, в пределах ГС видны пустоты и просветления вокруг перикарионов. В ЗС коры мозжечка также выявляется небольшое количество морфологически изменённых нейронов, у них отмечается искажение формы ядер и пикноз.
После проведения иммуногистохимической реакции во всех исследованных препаратах были обнаружены Iba-1-позитивные клетки с характерной для микроглиоцитов структурной организацией (рисунок, а). В МС и ГС коры мозжечка преобладали веретеновидной формы мультиполярные микроглиоциты с диаметром тела 7,2 ± 0,3 мкм, имеющие очень малый объем перинуклеарной цитоплазмы и сложно разветвленные отростки длиной 35 ± 2 мкм и толщиной 1,3 ± 0,03 мкм (таблица; рисунок, в). В области разветвления крупных отростков нередко наблюдались характерные для микроглиоцитов «натеки» цитоплазмы. В ЗС коры мозжечка преимущественно выявляются микроглиоциты округло-овальной формы с диаметром тела 10,1 ± 0,4 мкм и тремя-четырьмя мало ветвящимися длинными (47,8 ± 3 мкм) крупно-волнистыми отростками толщиной 1 ± 0,03 мкм (рисунок, д). Диаметр тела и длина отростков микроглиоцитов в ЗС значимо больше по сравнению с этими же параметрами микроглиоцитов в МС и ГС (таблица). Во всех слоях коры мозжечка рядом с капиллярами наблюдались единичные палочковидной формы малоотростчатые клетки, изогнутые по периметру кровеносного сосуда или вытянутые вдоль него. Также в периваскулярной области встречались единичные безотростчатые овальной формы макрофаги (МФ) с интенсивной цитоплазматической реакцией на антиген Iba-1. Помимо ядросодержащих микроглиоцитов все слои коры мозжечка содержат тонкие отростки, перинуклеарные участки которых не попали в плоскость среза.
При экспериментальном воздействии морфологические признаки микроглиоцитов изменяются и претерпевают некоторые преобразования (рисунок, б). Единичные микроглиоциты во всех слоях сохраняют свою форму, однако их большая часть в МС и ГС приобретает округлую или овальную форму, с увеличенной перинуклеарной областью (рисунок, г). Диаметр тела микроглиоцитов у экспериментальных животных составляет 11,2 ± 0,3 мкм, отростки изменённых микроглиоцитов лучше выявляются на срезе, укорачиваются до 18 ± 0,7 мкм и утолщаются до 2 ± 0,05 мкм. Данные морфометрические показатели значимо отличаются от контрольных значений в этих слоях (таблица). Число микроглиоцитов в МС и ГС коры мозжечка несколько возрастает, но статистически незначимо (таблица). В ЗС значимых изменений морфологических показателей микроглиоцитов не наблюдается, число их также значимо не увеличивается (рисунок, е). После воздействия анестетика микроглиоциты с короткими отростками, встречающиеся единично в группе К, визуализировать достаточно сложно, так как практически все микроглиоциты приобретают округло-овальную форму и их отростки укорачиваются.
Полученные данные свидетельствуют о том, что в слоях коры мозжечка крысы встречаются различные типы микроглиоцитов: в МС и ГС это уплощённые клетки с малым объёмом перинуклеарной цитоплазмы со сложно-разветвленными отростками, в ЗС – клетки округло-овальной формы с крупно-волнистыми мало ветвящимися отростками. Во всех слоях встречаются единичные периваскулярные малоотростчатые клетки и МФ. Данный факт, очевидно, обусловлен структурной организацией слоёв коры мозжечка и функциональной нагрузкой определенных областей мозга, микроглиоциты которых приобретают соответствующий фенотип. В наиболее развитой синаптической зоне коры мозжечка – молекулярном слое – преобладает рамнифицированная микроглия со сложной организацией отростков. В ЗС, где нейроны располагаются в виде плотных тяжей и гнёзд, микроглиоциты имеют мало ветвящиеся, но более длинные отростки, которые огибают тела нейронов, приобретая волнообразный ход. Наличие немногочисленных малоотростчатых периваскулярных микроглиоцитов во всех слоях коры мозжечка может указывать на взаимосвязь их структурной организации с выполнением ими защитных функций на уровне гематоэнцефалического барьера [9]. Помимо клеток с характерными признаками микроглиоцитов, при проведении иммуноцитохимической реакции на белок Iba-1 были выявлены округло-овальные клетки без отростков, располагающиеся периваскулярно. Очевидно, что эти клетки являются сходными с микроглиоцитами по функции макрофагами. Известно, что белок Iba-1 участвует в реорганизации цитоскелета и изменении конфигурации цитоплазматической мембраны – процессах, происходящих при фагоцитозе [12]. В связи с этим закономерным является то, что он экспрессируется не только в микроглиоцитах, но и в макрофагах.
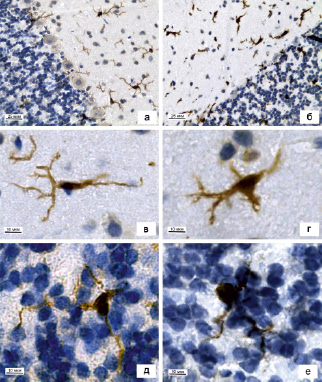
Микроглиоциты в коре мозжечка крысы: а – общий вид коры мозжечка контрольного животного, б – общий вид коры мозжечка после воздействия общего анестетика. Микроглиоцит в молекулярном слое (в) и в зернистом слое (д) коры мозжечка контрольного животного. Микроглиоцит в молекулярном слое (г) и в зернистом слое (е) коры мозжечка после воздействия общего анестетика. Иммуногистохимическая реакция на белок Iba-1 с подкраской гематоксилином
Морфометрические показатели микроглиоцитов в коре мозжечка контрольного животного и после длительной экспозиции севофлурана (6 ч)
|
Показатели |
Контроль |
Э (экспозиция севофлурана) |
||
|
Молекулярный и ганглионарный слои |
Зернистый слой |
Молекулярный и ганглионарный слои |
Зернистый слой |
|
|
Диаметр микроглиоцита (мкм) |
7,2 ± 0,3 |
10,1 ± 0,4** (p = 0,04156) |
11,2 ± 0,3* (p = 0,000122) |
10,7 ± 0,2 |
|
Длина отростков микроглиоцитов (мкм) |
35 ± 2 |
47,8 ± 3** (p = 0,01284) |
18 ± 0,7* (p = 0,000079) |
42,6 ± 1,8** (p = 0,000002) |
|
Толщина отростков (мкм) |
1,3 ± 0,03 |
1 ± 0,03 |
2 ± 0,05* (p = 0,00077) |
1,2 ± 0,03** (p = 0,000007) |
|
Число микроглиоцитов |
5,0 ± 0,1 |
4,0 ± 0,1 |
6,0 ± 0,4 |
4,0 ± 0,4 |
Примечание. * – показатели статистически значимо отличаются от группы контроля при р < 0,05; ** – показатели статистически значимо отличаются от показателей молекулярного и ганглионарного слоёв в пределах группы при р < 0,05.
Проведенное исследование показало, что морфологические изменения микроглиоцитов коры мозжечка при воздействии севофлурана зависят от слоя коры, в котором находится микроглиоцит. Токсическое воздействие анестетика ведет к активации микроглиоцитов, проявляющейся в виде подробно описанных в литературе гипертрофии, ретракции и уменьшении толщины отростков этих клеток [13]. Прежде всего, активация микроглиоцитов наблюдается в МС и ГС коры мозжечка, поскольку именно в этих слоях нейроны претерпевают наиболее значимые морфологические изменения, характеризующие клетки как погибшие. При этом, несмотря на то, что морфометрические показатели, характеризующие диаметр тела микроглиоцитов, длину и толщину их отростков в МС и ГС после воздействия анестетика значимо отличаются от контрольных показателей, число их значимо не изменяется (таблица). Известно, что микроглиоциты являются основными иммунными клетками головного мозга, ответственными за развитие нейровоспаления, проявляющегося увеличением количества Iba-1 положительных микроглиоцитов с изменением их формы до амебоидной и вырабатыванием ими провоспалительных цитокинов [14]. Установлено, что чрезмерная активация микроглиоцитов может приводить к патологическим процессам, в частности, к гибели нейронов, являясь одним из патологических механизмов нейродегенеративных заболеваний [15]. В ходе настоящего исследования не было выявлено увеличения числа микроглиоцитов и изменения их формы до амебоидной, что свидетельствует о невысокой степени активации микроглиоцитов, что, в свою очередь, снижает вероятность выработки ими провоспалительных цитокинов. Очевидно, что отсутствие чрезмерной активации микроглиоцитов является положительным фактором, так как вероятность развития нейродеструктивных процессов, связанных с медиаторами нейровоспаления, мала, а значит, нейроны не испытывают дополнительных повреждающих воздействий со стороны микроглии.
Таким образом, изучение структуры и функционального состояния микроглиоцитов в норме и при экспериментальной патологии является необходимым для решения актуальных задач нейробиологии, направленных на расшифровку тонких механизмов развития нейропатий, возрастных изменений головного мозга и прогрессирования нейродегенеративных заболеваний.
Работа выполнена в рамках темы государственного задания, № госрегистрации АААА-А18-118102590054-0.
Библиографическая ссылка
Сухорукова Е.Г., Юкина Г.Ю. МОРФОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА МИКРОГЛИОЦИТОВ КОРЫ МОЗЖЕЧКА КРЫСЫ // Международный журнал прикладных и фундаментальных исследований. – 2019. – № 6. – С. 30-34;URL: https://applied-research.ru/ru/article/view?id=12762 (дата обращения: 20.04.2024).

