Обобщение литературных данных и результатов наших многолетних научных исследований позволили заключить, что физико-химические изменения клеточных мембран (электропроводности, текучести липидной фазы, транспортных свойств) и мембрано-связанные процессы (энергетики, пролиферации, передачи нервного импульса, сигнализации, и метаболизма клетки) могут являться ключевыми в проявлении биологической активности физических факторов и ряда химических соединений на целом организме. Ранее нами было показано, что некоторые природные фенольные соединения (ПФС) из класса флавоноидов и многие синтетические фенольные соединения (СФС) из класса замещенных салициланилидов (ЗСА), бензимидазолов, а также двухосновных кислот (ДОК) группы ДОК1, содержащих гидроксильные группы во втором положении и различные заместители (NO2, галогены CI-, Br-) в 3,4,5 и 6 положении двух бензольных колец, обладают свойством транспортировать протоны через БЛМ, являясь ПФ [3,6,8]. Индукция протонной проводимости биологических мембран Мх и Хл под действием этих соединений приводила к снижению образования энергии в этих органеллах клетки путем разобщения процессов окисления субстратов и запасания энергии (окислительного фосфорилирования АДФ), а также к снижению образования активных форм кислорода (АФК). В опытах на лабораторных животных было обнаружено фармакологическое действие некоторых изученных препаратов – фасциолоцидное, бактерицидное, радиопротекторное, геропротекторное и противоопухолевое, оно коррелировало с их мембранотропным действием на БЛМ и митохондриях [3]. При γ-облучении лабораторных животных показано профилактическое (ферментно-ингибиторное) радиозащитное действие при относительно высоких концентрациях ДОК1, ЗСА и терапевтическое (адаптогенно-антиоксидантное) – при относительно низких концентрациях ДОК1 и природных флавоноидов [3, 5]. Был сделан вывод о том, что БЛМ и клеточные мембраны Мх могут служить тест-системой для отбора биологически активных соединений (БАС), проявляющих фармакологическое действие. Предложен экспресс-метод тестирования физиологического действия фенольных соединений (ФС) и других БАС на лабораторных животных по величине индуцированной ими ионной (протонной) проводимости БЛМ и по их действию на окислительное фосфорилирование Мх. В связи с перспективностью фармакологического использования ДОК при различных заболеваниях возникла целесообразность синтезировать и провести сравнительное изучение эффективности и механизма действия препаратов группы ДОК2, других СФС и ПФС на различных модельных и клеточных мембранных системах.
Целью исследования являлось дальнейшее исследование активности и механизма действия на ионный транспорт в модельных мембранных системах БЛМ и антиоксидантной активности (АОА) на липосомах потенциально эффективных фармакологических препаратов широкого спектра действия – новосинтезированных ароматических серусодержащих соединений класса ДОК из группы ДОК2 с гидроксильной ОН- -группой в четвертом положении двух бензольных колец и более широким кругом заместителей (Br, NO2, СООН, СООСН3) в третьем и пятом положениях бензольных колец по сравнению с ДОК1, а также ПФС – флавоноидов (эпигаллокатехинов, кверцетинов, убихинона), каротиноидов (ликопина) и СФС (тегалида, битионола, ионола и мексидола). Для достижения указанной цели предполагалось исследовать:
1) способность препаратов модифицировать ионную проводимость БЛМ,
2) природу этой проводимости,
3) АОА препаратов на липосомах по их влиянию на параметры хемилюминесценции (ХЛ),
4) зависимость протонофорной активности (ПФА) и АОА препаратов от их химической структуры (расположения ОН- группы и различных заместителей в бензольных кольцах), состава и рН среды, от концентрации препарата,
5) провести сравнительный анализ ПФА и АОА препаратов.
Материалы и методы исследования
Для исследования было использовано 21 химическое соединение из класса ДОК, синтезированное в ВИГИСе (Москва), степень их чистоты «х.ч.». Эта группа соединений ДОК2 содержала ароматические сульфиды, сульфоксиды и сульфоны с гидроксильными группами в четвертом положении бензольных колец с общей формулой
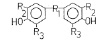
где R1 – S, SO, SO2 – группы; R2, R3 – Br, NO2, СООН, СООСН3 – группы в третьем и пятом положении бензольных колец. Химическая структура, условные обозначения и их действие на ионный транспорт – удельную электропроводность (проводимость) (Gм) БЛМ – приведены в таблице. ДОК2 сравнивались с ДОК1, среди которых исследовался битионол (ТХСД) [3]. Ранее приводится строение других соединений – ЗСА, катехинов, ИУК [3, 8].
Зависимость Gм БЛМ от концентрации модификаторов измерялась в водной среде с трис-буфером (20 мМ трис HCI фирмы «Sigma», США, рН 7,5). Для формирования БЛМ на отверстии диаметром I мм в тефлоновой ячейке были использованы н-декановые растворы с концентрацией 20 мг/мл общих липидов бычьего мозга (ОЛБМ), которые готовили непосредственно перед опытом. Для измерения электрического сопротивления мембраны Rм и трансмембранной разности потенциалов (ΔV) использовалась модифицированная нами электрическая схема [3]. Сопротивление Rм измеряли путем сравнения падения напряжения на стандартном (эталонном) резисторе и мембране. Rм и Gм рассчитывали по формулам Rм = Uм Rcn/E – Uм .и Gм = I∙Sм//Rм, где E – подаваемое на мембрану напряжение, Sм – площадь мембраны, Uм – падение напряжения на мембране, Rст – стандартное сопротивление мембраны. Для работы в линейной части вольтамперной характеристики БЛМ на мембрану подавали напряжение 20 мв, его переключали с «+» на «–» во избежание ассиметричности регистрации величины Rм. В вычислениях использовали среднюю величину.
Токи измерялись неполяризующимися хлорсеребряными электродами. Падение напряжения на мембране регистрировали электронным потенциометром КСП-4. Мембрану наблюдали в отраженном свете при помощи стереомикроскопа МБС-2. Площадь мембраны измеряли при помощи специального окуляра, укомплектованного измерительной микросеточкой, она составляла 7,9∙10-3 см2. Каждый опыт проводили на одной мембране с повтором 2–3 раза при комнатной температуре 22 °С.
Химические названия, условные обозначения и биологическая активность ДОК2 на БЛМ (в графе «Химическое название» условные обозначения: дифенилсульфид - СД, дифенилсульфоксид - СО, дифенилсульфон - СН)
|
№ п/п |
R1 |
R2 |
R3 |
Химическое название |
Усл. обозн. препа-рата. |
Макс. иссл. конц. (М) |
Макс. провод. на БЛМ (См/см2) |
|
1 |
S |
- |
- |
4,4ꞌ-диокси-дифенилсульфид |
СД |
10-3 |
5∙10-9 |
|
2 |
SO |
- |
- |
4,4ꞌ-диокси- дифенилсульфоксид |
СО |
2∙10-3 |
2∙10-9 |
|
3 |
SO2 |
- |
- |
4,4ꞌ-диокси-дифенилсульфон |
СН |
10-4 |
5∙10-9 |
|
4 |
S |
Br |
Br |
4,4ꞌ-диокси-3,5, 3 ꞌ,5ꞌ-тетрабром-СД |
ТБСД |
10-3 |
10-6 |
|
5 |
SO |
Br |
Br |
4,4ꞌ-диокси-3,5, 3 ꞌ,5ꞌ-тетрабром-СО |
ТБСО |
10-3 |
5∙10-8 |
|
6 |
SO2 |
Br |
Br |
4,4ꞌ-диокси-3,5, 3 ꞌ,5ꞌ-тетрабром-СН |
ТБСН |
10-3 |
1,5∙10-7 |
|
7 |
S |
СООН |
- |
4,4ꞌ-диокси-3,3 ꞌ-дикарбокси-дифенилсульфид |
ОКСД |
2∙10-3 |
1,2∙10-8 |
|
8 |
SO |
СООН |
- |
4,4ꞌ-диокси -3,3 ꞌ-дикарбокси- дифенилсульфоксид |
ОКСО |
2∙10-3 |
2,5∙10-8 |
|
9 |
SO2 |
СООН |
- |
4,4ꞌ-диокси-3,3 ꞌ-дикарбокси- дифенилсульфон |
ОКСН |
2∙10-3 |
1,15∙10-8 |
|
10 |
S |
СООСН3 |
- |
4,4ꞌ-диокси-3,3 ꞌ-диметил-карбокси-дифенилсульфид |
ОМСД |
10-3 |
1,3∙10-8 |
|
11 |
SO |
СООСН3 |
- |
4,4ꞌ-диокси-3,3 ꞌ-диметил-карбоксидифенилсульфоксид |
ОМСО |
5∙10-4 |
1,08∙10-8 |
|
12 |
SO2 |
СООСН3 |
- |
4,4ꞌ-диокси-3,3 ꞌ-диметил-карбокси-дифенилсульфон |
ОМСН |
5∙10-4 |
4,12∙10-9 |
|
13 |
S |
СООН |
Br |
4,4ꞌ-диокси-3,3 ꞌ-дикарбокси- 5,5ꞌ-дибром-дифенилсульфид |
ОКДС |
10-3 |
7,74∙10-9 |
|
14 |
SO |
СООН |
Br |
4,4ꞌ-диокси-3,3 ꞌ-дикарбокси- 5,5ꞌ-дибром-дифенилсульфоксид |
ОКДО |
2∙10-3 |
6,59∙10-8 |
|
15 |
SO2 |
СООН |
Br |
4,4ꞌ-диокси-3,3 ꞌ-дикарбокси-5,5ꞌ-дибром-дифенилсульфон |
ОКДН |
5∙10-4 |
1,3∙10-8 |
|
16 |
S |
СООСН3 |
Br |
4,4ꞌ-диокси-3,3 ꞌ-диметил-карбокси-5,5ꞌ-дибром-СД |
МБСД |
3∙10-4 |
5,8∙10-9 |
|
17 |
SO |
СООСН3 |
Br |
4,4ꞌ-диокси-3,3 ꞌ-диметил-карбокси-5,5ꞌ-дибром-СО |
МБСО |
5∙10-4 |
1,94∙10-8 |
|
18 |
SO2 |
СООСН3 |
Br |
4,4ꞌ-диокси-3,3 ꞌ-диметил-карбокси-5,5ꞌ-дибром-СН |
МБСН |
2∙10-4 |
4,5∙10-9 |
|
19 |
S |
СООСН3 |
NO2 |
4,4ꞌ-диокси-3,3 ꞌ-диметил- карбокси-5,5ꞌ-динитро-СД |
МНСД |
10-3 |
8,4∙10-9 |
|
20 |
SO |
СООСН3 |
NO2 |
4,4ꞌ-диокси-3,3 ꞌ-диметил- карбокси-5,5ꞌ-динитро- СО |
МНСО |
5∙10-4 |
1,25∙10-8 |
|
21 |
SO2 |
СООСН3 |
NO2 |
4,4ꞌ-диокси-3,3 ꞌ-диметил- карбокси-5,5ꞌ-динитро-СН |
МНСН |
10-3 |
5,7∙10-9 |
Мембрана и все высокоомные цепи были защищены от внешних электромагнитных полей дюралиевым экраном, для защиты от механических воздействий вся система была установлена на массивной металлической основе. Все приборы и экран были надежно заземлены. Предохранительные меры сводили до минимума электромагнитные наводки и механические вибрации, что давало возможность длительное время (8–10 часов) работать на одной мембране. Зависимость Gм от рН среды определялась в буферной водной среде, содержащей по 20 мМ цитрата, фосфата и бората калия. Препараты, растворенные в этаноле или диметилсульфоксиде (ДМСО), вводились в водную среду, омывающую БЛМ. Процент ошибки во всех опытах не превышал 10–15 %.
АОА соединений измерялась при добавлении двухвалентных ионов Fe2+по изменению интенсивности ХЛ липосом, отражающей скорость перекисного окисления липидов (ПОЛ). Исследовались различные концентрации препаратов на липосомах из яичного лецитина или из общих фосфолипидов печени крыс, взятых в концентрации 1 мг/мл [4]. Ионы Fe2+ (10-6 – 10-4 М) в небольшой концентрации существенно ускоряли ПОЛ в опытах, в клетке они являются прооксидантами, в результате взаимодействия Fe2+ с гидроперекисями липидов происходит разветвление свободнорадикальных липидных цепей, приводящее к увеличению количества свободных радикалов (СР) [1]. Средой измерения являлся раствор 20 мМ трис-НСl, рН 7,5. Высвеченные кванты света регистрировали фотоэлектрическим умножителем ФЭУ-38. Об активности препаратов судили по длительности латентного периода и величине амплитуды медленной вспышки ХЛ. Стандартным источником свечения ХЛ для определения чувствительности прибора служило урановое стекло.
Результаты исследования и их обсуждение
Влияние соединений ДОК2 на электропроводность БЛМ
Измерение удельной электропроводности Gм БЛМ (См/см2) при действии ДОК2 (рис. 1–3) в диапазоне концентраций 10-5–10-3 М показало, что сульфиды, сульфоксиды и сульфоны, имеющие такие заместители как карбоксильные (СООН) и карбоксиметильные (СООСН3) группы в 3,3’-положении, а также Br- или нитрогруппу в положении 5,5’ бензольных колец, являются малоэффективными (СД, ОК ДС, ОМСД, ОМСО, ОКСН, ОКСО, МБСО, МНСО) или практически неэффективными (СН, ОКДН, ОМСН, МБСН, МНСН). Низкая эффективность действия препаратов, указанных на рис. 1–3, на Gм БЛМ объясняется, по-видимому, их незначительным коэффициентом распределения ДОК2 липид/среда (102-103), а в случае 4,4’-диокси-3,З’-дикарбоксидифенильных (ОКСД, ОКСО, ОКСН) (рис. 2, б) и 4,4’-диокси-3,3’-диметилкарбоксидифенильных (ОМСД, ОМСО, ОМСН) производных (рис. 2, а) также затрудненной диссоциацией, «экранизацией» ОH- -группы положительно заряженными карбоксильной или карбоксиметильной группами. Препараты, содержащие сульфоксидный (SO) мостик между бензольными кольцами (ОКДО, ОКСО и МБСО) (рис. 1–3, кривые 2), были более эффективны на БЛМ.
Вещества, аналогичные вышеназванным, но с двумя бромами в положениях 3,3’ и 5,5’ бензольных колец, были наиболее эффективными и имели, в отличие от неактивных и малоэффективных препаратов, указанных на рис. 1–3, линейную зависимость проводимости (Gм) БЛМ от концентраций 10-5–10-3 М (рис. 4). Пунктирные линии (прямые) 1–3 проведены на основе теоретических расчетов.
Увеличение проводимости БЛМ под влиянием этих наиболее активных по величине Gм препаратов из группы ДОК2 при их концентрации 10-3 М происходило максимально до 5.10-8 (ТБСО), 1,5,10-7 (ТБСН) и 10-6 Cм/см2 (ТБСД) и было обусловлено увеличением кислотных свойств протона препарата за счет отрицательного индукционного эффекта, создаваемого галогенными заместителями, согласно теории строения органических соединений [2]. В таблице приведены эффективности остальных препаратов (см. «Материалы и методы»).
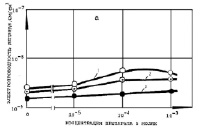
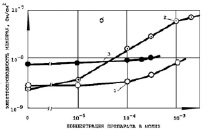
Рис. 1. Зависимость проводимости БЛМ из ОЛБМ (20 мг/мл в н-декане) от концентрации ДОК2 , вводимых в водную среду (20 мМ трис-НСl, рН 7,5) растворенными в ДМСО. Препараты: а) 1 – СД, 2 – СО, 3 – СН; б) 1 – ОКДС, 2 – ОКДО, 3 – ОКДН


Рис. 2. Условия те же, как и на рис. 1. Препараты: а) 1 – ОМСД, 2 – ОМСО, 3 – ОМСН, б) 1 – ОКСД, 2 – ОКСО, 3 – ОКСН
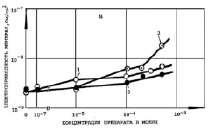

Рис. 3. Условия те же, как и на рис. 1. Препараты: а) 1 – МБСД, 2 – МБСО, 3 – МБСН, б) 1 – МНСД, 2 – МНСО, 3 – МНСН
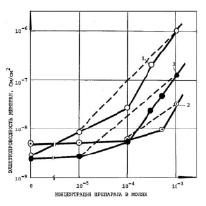
Рис. 4. Условия те же, как и на рис. 1. Препараты: 1 – ТБСД, 2 – ТБСО, 3 – ТБСН
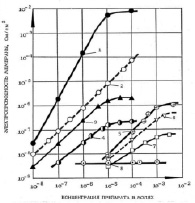
Рис. 5. Условия те же, как и на рис. 1. Препараты: 1 – тегалид, 2 – фенилбарен, 3 – ТХСД в ДМСО, ТХСД в этиловом спирте, 5 – ионол, 6 – ИУК,7 – ЭГК, 8 – 2-фенилоксазол
Таким образом, исследованные фенольные соединения по своей ионофорной активности образуют следующий ряд: Т > ФБ > ТХСД в ДМСО > ТХСД в этиловом спирте > ионол > ИУК > ЭГК > ЭГКГ > Q10 > мексидол > АК > каротиноид ликопин (рис. 5). Очевидно, что ПФС (убихинон, ликопин, катехины, кверцетины и др.) являются слабыми по эффективности на БЛМ соединениями по сравнению с СФС, они незначительно (в 5–10 раз) увеличивали Gм БЛМ при концентрациях 10-5–10-3 М. Среди СФС также имеются слабоэффективные ПФ на БЛМ – ионол и мексидол, которые, как и ПФС, относятся к классу замещенных фенолов и их производных. Другие СФС (ТХСД, Т, трихлорфенол, пентахлорфенол, 2,4-ДНФ, ТТФБ, ЗСА с галогенными заместителями Cl-, Br- под шифром Г-1042, Г-1049) являются более эффективными протонофорами на БЛМ, действующими при значительно меньших концентрациях, начиная с милли (10-6 М) или наномолярных концентраций (10-9 М) [3, 5, 8].
Природа электропроводности БЛМ
Для определения природы Gм БЛМ в присутствии ДОК2, были проведены отдельные опыты по измерению зависимости Gм БЛМ от концентрации ионов водорода водной среды в присутствии исследованных веществ. Измерения величины разности мембранного потенциала от рН среды проводились в буферной водной среде без подачи напряжения (20 мв) на мембрану, в условиях нулевого тока. Непроницаемость БЛМ для протонов позволяла создавать на мембране градиент ионов водорода опытным путем. Внутренняя мембрана Мх, моделью которой является БЛМ, также непроницаема для протонов, что необходимо для поддержания градиента ионов водорода как составляющей компоненты (наряду с электрической компонентой) трансмембранной разности потенциалов, используемой для образования энергии в клетке в виде макроэргических молекул АТФ. Если по одну сторону БЛМ добавляли кислоту или щелочь, таким образом создавая градиент рН на мембране на одну единицу (в пределах 6,5–7,5), то добавление эффективного препарата ДОК1 или ДОК2 в концентрации 10-8–10-4 М в раствор измерительной ячейки приводило к возникновению разности потенциалов 58 мв, причем знак «плюс» всегда был на стороне более высокого рН. Экспериментально было доказано, что в области кислых рН = 1,0–7,0, включающей область рН = рК (константы диссоциации) препарата, эта разность потенциалов ΔV хорошо описывалась уравнением Нернста:
ΔV= ΔVн = ΔрН.2,3 RT/F,
где ΔVн – диффузионный водородный потенциал, ΔрН – разность ионов водорода по обе стороны мембраны, имеющая знак, соответствующий трансмембранному градиенту ионов водорода или гидроксила, R – универсальная газовая постоянная, T – абсолютная температура, F – число Фарадея. Возникновение нернстовского трансмембранного потенциала при добавлении препарата, зарегистрированная при наличии градиента рН на мембране, равного единице при низких значениях рН менее 8,0 в условиях нулевого тока, позволила убедиться в том, что проведение тока через мембрану в присутствии препаратов ДОК осуществлялась ионами водорода (Н+), а не ионами гидроксила (ОН-). Следовательно, в присутствии более эффективных препаратов ДОК2 мембрана ведет себя как избирательный водородный электрод с сопротивлением 103 ом/см2. В щелочной области рН 8–12, где концентрация ионов водорода меньше, мембранный потенциал полностью исчезает. Таким образом, наши экспериментальные данные по исследованию ФС с близкой структурой из класса ДОК1,2 (ОH- -группа во втором и четвертом положении бензольного кольца и заместители CI, NO2, Вr, CООH, СООСН3) дают основание считать, что большинство из исследованных препаратов индуцируют протонную проводимость, т.е. они являются истинными ПФ на БЛМ (трансмембранными переносчиками протонов) при данных условиях.
Проводимость Gм БЛМ при добавлении других исследованных препаратов также зависела от концентрации ионов водорода. Для большинства СФС, в частности, для изученных нами Т и ТХСД, максимумы Gм БЛМ расположены при физиологических рН = 7,8 и рН = 6,1, которые равны рК препаратов, а при более кислых или щелочных рН величины Gм резко снижены, поэтому Gм при рН = 7,5 имела высокие значения. Для ПФС (ЭГК, ЭГКГ, АК) и СД, СО, СН из группы ДОК2 без заместителей в бензольных кольцах максимумы Gм находятся в щелочной области рН, совпадающие с рК данных веществ, с чем связаны низкие значения проводимости при физиологическом значении рН = 7,5. Для ФБ в связи с отсутствием ОН- групп максимум Gм был не столь выражен. В отдельных опытах было показано, что проводимость БЛМ в присутствии ПФС и СФС не зависела от концентрации других одновалентных катионов (K+, Na+) и анионов (Cl-), двухвалентных катионов (Са2+ ). Эти опыты доказывали протонную природу проводимости БЛМ и способность ФС к переносу протонов.
Механизм трансмембранного транспорта протонов
Для высокоактивного на БЛМ препарата тегалида из класса ЗСА (рис.5, кривая 1) была получена квадратичная зависимость проводимости БЛМ от концентрации препарата. Это означает, что тегалид осуществляет транспорт протонов через мембрану по механизму подвижных переносчиков димерного (НА2-) варианта. Согласно принятой на сегодняшний день трехстадийной модели протон переносится димером между анионной (А-) и протонированной (НА) формой препарата, при этом димер образуется на межфазной границе мембрана/раствор.
На рис. 5 показана также линейная зависимость Gм БЛМ от концентрации исследованных СФС (ФБ, ТХСД в ДМСО и в этаноле, ионол, кривые 2–5) и ПФС (ИУК, ЭГК, кривые 6–7) при физиологическом значении рН 7,5. Кривые Gм для мексидола, АК, ликопина и коэнзима Q10 на рисунке не указаны. Молекулярный механизм ионного транспорта через мембрану для этих препаратов, как и для классических протонофоров, осуществляется по механизму подвижного переносчика мономерного варианта (А-) [8, 12]. Известно, что БЛМ непроницаема для Н+, поэтому протоны могут проходить через бислой только в виде нейтрального комплекса (НА) с ПФ. Перенос Н+ происходит следующим образом Под влиянием электрического поля указанной полярности анионы (А-) движутся справа налево через углеродную фазу мембраны, вследствие чего концентрация анионов на левой стороне мембраны увеличивается. Такой перенос, со своей стороны, ведет к гетерогенной реакции следующего типа: А- + Н+ ↔ НА. Вследствие такой реакции, протекающей на границе раздела мембрана/раствор, концентрация НА в одном из отсеков ячейки увеличивается. В результате этого концентрационного градиента нейтральная форма ПФ диффундирует через бислой к правой стороне, где происходит освобождение протона в водной фазе вследствие уменьшения концентрации А- под воздействием приложенного потенциала и протон из одного отсека с водной средой переносится в другой отсек ячейки через липидный бислой.
Наиболее эффективные препараты на БЛМ из группы ДОК2 (ТБСД, ТБСО и ТБСН) с двумя галогенными заместителями (Bг-) в бензольном кольце, имеющие линейную зависимость Gм БЛМ от концентрации препарата 10-4–10-3 М (рис. 4), также осуществляют протонный перенос через мембрану по механизму переносчиков мономерного варианта (А-), как и ранее исследованные нами препараты из группы ДОК1 2,2’-диокси-3,3’,5,5’-тетрахлордифенилсульфид (ТХСД – битионол), 2,2,-диокси-5,5,-дихлордифенилсульфид (ДХСД – оксид), 2,2,-диокси-3,3,-дибром-5,5,-дихлордифенилсульфид (БХСД – галосфен), 2’-диокси-3,3’,5,5’,6,6’-гексахлордифенилсульфид (ГХСД – гексид) и др. [3, 8].
ПФС и СФС, не имеющие линейной зависимости проводимости БЛМ от их концентрации, осуществляют неспецифическое действие на мембрану. Среди них ДОК2, которые практически не повышают Gм БЛМ – СН, СД, СО без заместителей в бензольных кольцах и препараты с карбоксильной, карбоксиметильной и нитрогруппой в качестве заместителей. Существенных отличий в механизме протонного транспорта сульфидов, сульфоксидов и сульфонов ДОК2 не наблюдалось в связи с тем, что ОН- -группы, ответственные за кислые свойства молекул, расположены достаточно далеко от серного мостика, и степень его окисленности заметно не влияет на диссоциацию протона ОН- группы. 2-фенилоксазол без ОН- -групп и без галогенных заместителей был практически неактивен на БЛМ (рис. 5, кривая 8), что указывает на необходимость гидроксильных групп для проявления протонофорной активности (ПФА) препаратов.
Зависимость протонофорной активности препаратов на БЛМ от различных факторов
Как следует из вышеизложенного экспериментального материала, ПФА исследованных ФС определяется структурой соединения – количеством и расположением ОН- групп, а также типом и расположением заместителей, влияющих на степень диссоциации ОН- групп, о которой судили по величине константы диссоциации рК. Возможность переноса протонов соединениями определяется также их способностью образовывать комплексы с Н+.
Было показано, что эффективность препаратов ДОК2 на БЛМ зависит от величин коэффициента их диссоциации рН/рК, которые были измерены нами методом титрования. Наблюдалось значительное увеличение проводимости БЛМ при исследовании препаратов в области рН, близких к рК, в частности, для ДОК2 ТБСД, ТБСО, ТБСН при рН = 8,2, 7,8, 6,5 в концентрации 2∙10-4 М. Таким образом, активность ФС зависела от рН среды измерения.
Эффективность ПФС и СФС на БЛМ, как было показано ранее с помощью флуоресцентных зондов (ДМХ), определяется также способностью изменять структуру липидной фазы, причем липидной фазы низкой полярности, способствуя увеличению ее текучести [9]. Об этом свидетельствовала корреляция между способностью ФС изменять структуру липидов и активностью ФС на БЛМ. Для эффективного действия на проводимость мембран препарат должен быть способным связываться с липидами, что было выявлено по конкуренции между препаратом и зондом (ДМХ) [9]. Эффективный протонофор, как и его диссоциированные формы (А- – , АН-) и их комплексы с протонами, должны хорошо растворяться в липидах (для оценки растворимости определялся коэффициент распределения липид/среда) и обладать подвижностью в мембране.
Сравнение протонофорной активности ДОК1 и ДОК2
ДОК2 оказались менее эффективными на БЛМ, чем ДОК1, что может быть связано с положением ОН- -группы. Можно предположить, что ОН- -группы, расположенные в 4ом положении бензольных колец, образуют более устойчивые связи с соседними заместителями, чем во 2ом положении, что в меньшей степени способствует диссоциации ОН- -группы ДОК2 и индукции проводимости БЛМ, чем ДОК1. ДОК2 были менее активны также из-за их более низкого сродства к липидам (у них более низкий коэффициент распределения липид/среда, равный 102–103). Их небольшое сродство к липидам можно объяснить тем, что при нейтральном рН большая часть этих молекул представлена двухзарядными анионами. В отличие от сильных кислот и оснований, ДОК1 и ДОК2 являются слабыми кислотами и неполярными соединениями, поэтому проникают через БЛМ и нативные клеточные мембраны, однако при увеличении у них количества полярных групп растворимость их в липидах и проницаемость мембран для них уменьшается. Более высокая протонофорная эффективность ДОК1 по сравнению с ДОК2 может объясняться наличием у ДОК1 более эффективных галогенных заместителей, оттягивающих на себя электронное облако положительно заряженных протонов и увеличивающих их диссоциацию. Карбоксильная и карбоксиметильная группы ДОК2, наоборот, затрудняли, экранировали диссоциацию ОН- -группы, протонофорная эффективность препаратов с этими заместителями была ниже, чем с галогенными (Br-). Эффективность ДОК по степени их влияния на Gм БЛМ определяется типом, количеством и расположением заместителей в бензольных кольцах и убывает в ряду: Br-- > CI-> I-> NO2 > COOH-> COOCH3.
Антиоксидантные свойства ДОК2
Учитывая важную роль АО для лечения различных заболеваний, были исследованы антиоксидантные свойства ДОК2 по их действию на ПОЛ и их прооксидантная активность, для чего было проведено исследование их влияния на параметры ХЛ, стимулированной добавлением в среду солей двухвалентных ионов Fe2+ . Добавление Fe2+ к искусственным (липосомам) и биологическим мембранным системам (митохондриям, эритроцитам) усиливает высвечивание квантов света, обусловленное ПОЛ [1].
Были получены сравнительные экспериментальные данные определения ПФА и АОА исследованных препаратов по влиянию их на проводимость Gм БЛМ и параметры ХЛ на липосомах, соответственно. Слабоэффективные препараты ОКДО, ОМСД, ОМСО, МНСО, незначительно увеличивающие Gм БЛМ (в 5–10 раз) при концентрации 10-4–10-3 М (рис. 1–3), являются менее эффективными АО, чем препараты, не проявляющие протонофорную активность на БЛМ (СО, СН, ОКДН, ОМСН, МНСН, МБСН). Препараты, увеличивающие электропроводность БЛМ на 1,5–2 порядка (ТБСО, ТБСН, ТБСД, ОКДО) при концентрациях 10-5–10-3 М (рис. 3, 4), проявляли невысокую АОА. Таким образом, препараты ДОК2, не эффективные или слабо эффективные на БЛМ, являлись более эффективными АО, они в большей степени увеличивали латентный период медленной вспышки ХЛ при введении соли Fe2+ в исследуемый раствор по сравнению с этим периодом, измеренным при добавлении препаратов ДОК2 с более высокой ПФА на БЛМ. Сравнительное исследование ПФА и АОА классических антиоксидантов (ионола, токоферола, убихинона, АК, мексидола) и растительных флавоноидов (кверцетина, ликопина, стильбена и эпигаллокатехина) выявило аналогичную закономерность отсутствия корреляции ПФА и АОА. Сравнительный анализ данных, полученных по действию препаратов на Gм БЛМ и ХЛ липосом, позволяет заключить, что некоторые из ДОК2, как и препараты из других классов, проявляющие низкую ПФА, обладают высокой АОА и, наоборот, более эффективные ПФ были мало эффективными АО. ОН- -группа необходима для проявления ПФА, она может участвовать также и в проявлении АОА у ПФС (флавоноидов) и СФС (исследованных нами ДОК). ФС, являющиеся протонофорами за счет диссоциации протона ОН- -группы, осуществляют перенос Н+ через мембрану при наличии трансмембранного градиента рН. АОА этих соединений обусловлена окислением их гидроксильной группы в кетогруппу, при этом АО являются донорами отрицательно заряженных электронов для свободных радикалов (СР) – молекулярных частиц с неспаренными электронами, являющихся АФК и азота, продуктами окисления липидов. Отсутствие корреляции между ПФА препаратов на БЛМ и их влиянием на ПОЛ может быть связано с наличием или отсутствием галогенных, карбоксильных, карбоксиметильных заместителей, с количеством и положением ОН- -групп в бензольных кольцах. Наличие галогенных заместителей в химической структуре ДОК1, несущих отрицательный заряд, способствует повышению протонофорной эффективности этих ФС при увеличении способности положительно заряженного протона к диссоциации, а АОА, наоборот, уменьшается из-за снижения способности соединения отдавать отрицательно заряженные электроны перекисным СР. Другие заместители (карбоксильные и карбоксиметильные группы в молекуле ДОК2 или метильные группы в молекуле классического антиоксиданта ионола), несущие положительный заряд, наоборот, уменьшают («экранируют») диссоциацию ОН- -группы и снижают эффективность этих соединений как ПФ, но способствуют увеличению их АОА. Отмечено, что различные группы ФС обладают способностью восстанавливать сильно окисленные продукты, в первую очередь СР, за счет своего низкого восстановительного потенциала, который для большинства ФС колеблется в диапазоне 250–750 мВ [11]. ФС за счет высокой разницы восстановительных потенциалов легко вовлекаются в одноэлектронные реакции с различными радикалами (супероксидный, пероксидный, гидроксильный, алкоксильный), значения восстановительных потенциалов которых существенно выше – 0,9–2,13 В. Их АОА сопровождается разрывом цепи свободнорадикального окисления RO2 + ФСОН → ROOН + ФСО, где RO2 и ФСО – нерадикальные продукты окисления ФС, а R – алкильная или арильная группа [1,4] Отсутствие заместителей в бензольных кольцах ведет к снижению ПФА и увеличению АОА препарата как у ПФС, так и СФС [3]. Низкая диссоциация протона различных молекулярных групп наблюдается при отсутствии различных заместителей у химических соединений: ОН группы у ФС, SH группы у водорастворимых тиолов и NH группы у замещенных салициланилидов. АОА этих соединений, однако, высокая, поскольку отсутствие заместителей не уменьшает их эффективность в качестве доноров электронов для активных акцепторов этих частиц – СР. При отсутствии ОН- группы или замене ее на ОNa , на ОК препараты ДОК1 и ЗСА были неэффективны как ПФ, но были активны как АО, возможно, вследствие их действия, связанного со способностью ингибировать активность прооксидантных ферментов, ответственных за генерацию активных форм кислорода [7, 11].
В заключение следует сказать, что исследованные мембранотропные препараты – переносчики протонов – активно влияют не только на параметры искусственных БЛМ, но также и на клеточные мембраны и связанные с ними биохимические процессы [3, 8]. В настоящем сообщении показана их АОА, обнаруженная у многих лекарственных соединений. Приводятся экспериментальные данные, свидетельствующие о том, что ряд природных и синтетических антиоксидантов фенольной природы, уже применяемых в медицине, являются слабыми протонофорами на модельных мембранных системах – ионол, кверцетины, катехины, убихинон, мексидол, аскорбиновая кислота. Для поиска и отбора активных АО предложен экспресс-метод исследования их проводимости на БЛМ и их хемилюминесценции на липосомах среди ФС с протонофорным механизмом действия, несущественно увеличивающих электропроводность мембран. Активными АО являлись слабо эффективные на БЛМ исследованные нами ранее препараты ДОК1 при относительно низких концентрациях (10-8 –10-6 М), они могут являться перспективными для использования в медицинской практике. Высокие концентрации ДОК1 (10-4 –10-3 М), приводили в наших опытах к выявлению у этих соединений прооксидантных свойств, способствующих ПОЛ и снижению трансмембранного потенциала митохондрий, необходимого для образования энергии в клетке. Нами показан высокий профилактиченский и терапевтический эффект для СФС дибунола (10-4–10-5 М), ПФС дигидрокверцетина, ß-каротина и ликопина, флавонолов и антоцианов (10-3–10-6 М) при действии летальных доз γ-облучения и адронов высоких энергий [10]. Важным результатом работы является возможность применения в качестве потенциальных терапевтических препаратов при лечении широкого спектра различных заболеваний (в том числе изученных нами патологий, вызванных ионизирующим и неионизирующим облучением) более эффективных на БЛМ СФС при очень низких, совершенно нетоксических концентрациях 10-8–10-6 М, при которых они обладают, по нашим данным, высокой АОА. Выявленные зависимости ПФА от химической структуры позволят, как мы полагаем, синтезировать более эффективные протонофоры, которые возможно будет применять в медицинской практике как радиопротекторы профилактического действия, радиосенсибилизаторы для лечения онкозаболеваний, бактерициды, фасциолоциды и фунгициды.
Выводы
1. Были исследованы величины и механизмы ионной проницаемости модельных мембранных систем БЛМ под действием ряда ПФС и СФС. Выяснено, что ароматические сульфиды, сульфоксиды и сульфоны (21 вещество), являющиеся аналогами препарата ТХСД (битионола), содержащие гидроксильную ОН- группу в 4ом положении и 4 иона галогена Br- в 3,3ꞌ и 5,5ꞌ-положениях бензольных колец (ТБСД, ТБСО, ТБСН из группы ДОК2), являются наиболее эффективными индукторами протонной проводимости на БЛМ, линейно зависящей от их концентрации (10-5 – 10-3 М), что свидетельствовало о переносе протонов по механизму подвижных переносчиков мономерного варианта (А-). Аналогичные результаты получены для других СФС (ФБ, ТХСД, ионол, мексидол) и ПФС (ИУК, ЭГК, ЭГКГ, АК, убихинон Q10, ликопин). Высокоактивный на БЛМ тегалид (Т) из класса ЗСА имел квадратичную зависимость проводимости БЛМ от концентрации (10-9–10-5 М), которая свидетельствовала об осуществлении транспорта протонов через мембрану этим препаратом по механизму подвижных переносчиков димерного варианта (НА2-). Вышеупомянутые препараты являются истинными протонофорами на БЛМ и образуют следующий ряд активности: Т> ТХСД в ДМСО > ТХСД в этиловом спирте > ионол > ИУК > ЭГК > ЭГКГ > АК > убихинон Q10 > мексидол > ликопин. В целом, СФС были более эффективны, чем ПФС. Среди СФС выявлены высокоэффективные протонофоры, такие как тегалид и фенилбарен, но нами были обнаружены также малоэффективные СФС – мексидол, ДОК2, сходные по активности с ПФС (АК, ИУК, катехины, кверцетины, убихиноны).
2. Протонофорная активность исследованных ФС зависит от химической структуры соединения и определяется количеством и расположением ОН- групп, типом, наличием и расположением заместителей, влияющих на степень диссоциации ОН- групп, о которой судили по величине константы диссоциации рК. Галогенные заместители Вг- ДОК2, С1- и I- ДОК1, нитрогруппа (NО2) ДОК1 и ДОК2 формировали ряд активностей Br--> CI-> I- > NO2 > СООН > COOCH3 и способствовали увеличению диссоциации протонов ОН- группы и, таким образом, повышению их протонофорной эффективности. Карбоксильная и карбоксиметильная (препаратов ОКДН и ОМСН) группы, наоборот, затрудняли ее диссоциацию, протонофорная эффективность была ниже, чем с галогенными заместителями. Препараты ДОК2 без заместителей (СД, СО и СН) или с карбоксильной группой (ОКДН и ОМСН) в концентрации 10-4 М были практически неэффективными на БЛМ при исследовании их в диапазоне рН 3,0–11,5 из-за того, что у этих соединений рК ОН- группы находились только в очень щелочной области рН (для СД, СО и СН рК равны 13,9, 12,8 и 11,7), в отличие от ДОК1, имеющих 2 рК в нейтральной и щелочной областях. Эффективность действия ФС на проводимость БЛМ, таким образом, зависела от концентрации ионов Н+ (рН среды измерения), но не зависела от концентрации других одно- и двухвалентных ионов (K+, Na+, Cl-, Са2+). Эти данные свидетельствовали о протонной природе проводимости БЛМ.
3. Эффективность ПФС и СФС на БЛМ, как было показано ранее с помощью флуоресцентных зондов (ДМХ), определяется также способностью изменять структуру липидной фазы, причем липидной фазы низкой полярности, способствуя увеличению ее текучести и более высокой растворимости препарата в липидах, которая оценивалась величиной коэффициента распределения липид/среда. Более низкая эффективность действия ДОК2 на БЛМ по сравнению с ДОК1, содержащими ОН- группу во 2 положении бензольных колец, связана с их более низким коэффициентом распределения 102–103. Более высокая протонофорная эффективность ДОК1 по сравнению с ДОК2 может объясняться наличием у ДОК1 более эффективных галогенных заместителей, оттягивающих на себя электронное облако положительно заряженных протонов и увеличивающих их диссоциацию.
4. Была исследована АОА ДОК2 при определении параметров хемилюминесценции ионов Fe2+, связанной с действием препаратов на ПОЛ в липосомах. Препараты, увеличивающие электропроводность БЛМ на 1,5–2 порядка (ТБСО, ТБСН, ТБСД, ОКДО), проявляли невысокую АОА. Препараты ДОК2, не эффективные и слабо эффективные на БЛМ, являлись активными АО. Показана обратная корреляция между протонофорной активностью ДОК2, СФС, являющихся классическими АО (ионола, АК, убихинона, мексидола), ПФС (кверцетина, ликопина, стильбена, ЭГК, ЭГКГ) на БЛМ и их АОА на липосомах. В случае ДОК2 такая закономерность может быть связана с различным действием заместителей, несущих положительный или отрицательный заряд, на способность ДОК2 к диссоциации протона ОН- группы, влияющей на протонофорную эффективность и на их способность отдавать отрицательно заряженные электроны перекисным СР, влияющей на АОА.
5. Некоторые ДОК2 и ранее изученные СФС из группы ДОК1 с ПФА и АОА могут быть потенциально эффективными фармакологическими средствами при различных заболеваниях (сердечно-сосудистым, неврологическим, онкологическим). Активные протонофоры, индуцирующие высокую протонную проводимость на БЛМ, могли бы оказаться эффективными фармакологическими препаратами: противофасциолезными и бактерицидными средствами при инвазивных и инфекционных заболеваниях, радиопрофилактическими защитными препаратами при действии облучения, радиосенсибилизаторами при лечении онкозаболеваний. Активные антиоксиданты с низкой протонофорной активностью могли бы оказаться эффективными терапевтическими препаратами при лечении последствий действия облучения (γ-радиации, УФ излучения, адронов высоких энергий) и других внешних воздействий. Особенностью биологического действия соединений фенольного комплекса является широкий спектр молекулярных мишеней, на которые они могут воздействовать в организме, и, следовательно, большие потенциальные возможности их фармакологического действия и применения в медицине.
Библиографическая ссылка
Кожокару А.Ф. ПРОТОНОФОРНОЕ И АНТИОКСИДАНТНОЕ ДЕЙСТВИЕ ПРИРОДНЫХ ФЛАВОНОИДОВ, СИНТЕТИЧЕСКИХ СЕРУСОДЕРЖАЩИХ ДВУХОСНОВНЫХ КИСЛОТ И ДРУГИХ ФЕНОЛЬНЫХ СОЕДИНЕНИЙ // Международный журнал прикладных и фундаментальных исследований. – 2014. – № 11-1. – С. 39-49;URL: https://applied-research.ru/ru/article/view?id=6070 (дата обращения: 19.04.2024).

