Этиология ВЗК остается до конца неизвестной. Патогенез заболеваний представляет собой процесс крайне сложного и комплексного взаимодействия различных патофизиологических механизмов аутоиммунного воспаления, развивающихся на фоне генетической предрасположенности к неадекватному иммунному ответу как со стороны иммунной системы организма в целом, так и локальной иммунной системы ЖКТ в частности [4, 9].
К настоящему моменту в научной среде сформировался устойчивый интерес к роли фибробластов при этом заболевании. По современным представлениям, они могут претендовать на роль ключевых клеток при БК, и от спектра продуцируемых ими компонентов во многом зависит дальнейшее течение болезни, направление на репарацию или обострение, длительность ремиссии [3]. Одним из возможных путей скрининга веществ, продуцируемых клеткой, является времяпролетная хроматография, позволяющая провести спектральный анализ «секретома» клеток. В настоящее время спектр белков стал самостоятельным объектом исследования, так называемой «молекулярной сигнатурой» или «штрих-кодом», не требующим индивидуальной идентификации. Понятие о молекулярной сигнатуре возникло относительно недавно в качестве альтернативного направления протеомного анализа и активно развивается.
Целью нашего исследования стало выявление особенностей белкового спектра культуральной жидкости, полученной при многократном культивировании фибробластов в норме и патологии.
Материалы и методы исследования
Объектом исследования являлась культуральная жидкость культур фибробластов, полученных из биоптатов кожи четырех условно здоровых и трех детей с болезнью Крона в возрасте 14–17 лет. Диагноз ставили на основании комплексного обследования, включающего в себя клинико-лабораторные данные, а также эндоскопическое обследование слизистой оболочки кишечника с морфологическим анализом биоптатов. Протокол обследования был одобрен этическим комитетом. У всех детей и их родителей было получено информированное согласие на участие в исследовании. Фибробласты культивировали до 5 пассажей в среде ДМЭМ с 10 % эмбриональной телячьей сывороткой и антибиотиками (25 000 ед. пенициллина и 25 000 мкг стрептомицина), дополненной L-глютамином (150 мг) в культуральных флаконах объемом 75 см2 при 37 °С в атмосфере с 5 % СО2 согласно стандартному протоколу. Фенотип клеток определялся на проточном цитофлюориметре BD FACS Canto II (Becton, Dickinson and Company, США) с помощью набора для идентификации мезенхимальных клеток Human MSC Analysis Kit (США). Определялась экспрессия CD73, CD90, CD105, CD44, CD13; в качестве негативного контроля использовались CD11b, CD19, CD34, CD45, HLA-DR.
После каждого пассажа культуральную жидкость отбирали и определяли белковый спектр. Масс-спектры (диапазон масс от 1000 до 17000 Да) были получены на масс-спектрометре MALDI MS Autoflex III TOF/TOF (Bruker Daltonics, США), работающем в положительном линейном режиме. Калибровка масс-спектрометра осуществлялась с помощью белковых стандартов (Peptide Calibration Standard и Protein Calibration Standard II, «Bruker Daltonics»).
По каждому спектру был получен масс-лист с указанием отношения массы к заряду (m/z) каждого пика, его площади и интенсивности (ClinProTools 2.1 software («Bruker Daltonics»)). Эти данные экспортировали в таблицы MS Excel, и значения площадей в повторных измерениях усредняли.
Данные масс-листов были сгруппированы в кластеры. Кластеризация проводилась на основании сходства молекулярных весов. Количество протеиновых фрагментов во всех кластерах масс-спектра культуральной жидкости каждого пассажа принималось за 100 % , в каждом кластере подсчитывался процент содержания белковых фрагментов от общего количества в масс-спектре.
Полученные данные обрабатывались с помощью пакета прикладных программ «Graph Pad Prism 6.0». Для определения статистической значимости выявленных различий использовался критерий Тьюкей. Различия считались достоверными при P ≤ 0,05.
Результаты исследования и их обсуждение
К настоящему моменту в научной среде сформировался устойчивый интерес к роли фибробластов при болезни Крона. Фибробласты как «сторожевые клетки», «резидентные охранники» могут играть свою негативную роль, являясь проводниками и источниками сигналов, стимулирующих воспалительную реакцию [3, 7]. С другой стороны, обладая уникальным потенциалом к дифференцировке и являясь продуцентами целого спектра биологически активных веществ, эти клетки могут и должны способствовать выздоровлению и длительной ремиссии [6].
Анализ результатов фенотипирования клеточных культур от всех пассажей не показал статистически значимой разницы в экспрессии клеточных маркеров между больными и условно здоровыми детьми. Начиная с пассажа «А», клеток, экспрессирующих маркеры CD11b, CD19, CD34, CD45, HLA-DR, в исследуемых образцах обнаружено не было. Результаты фенотипирования по маркерам CD73, CD90, CD105, CD44, CD13 приведены в таблице.
Сравнение CD фенотипов фибробластов условно-здоровых детей и детей с болезнью Крона в ходе последовательного пассирования
|
Маркер |
Дети |
Пассаж А |
Пассаж Б |
Пассаж В |
Пассаж Г |
Пассаж Д |
|
CD90 |
Здоровые |
84,13 ± 1,84 |
94,77 ± 2,19 |
94,37 ± 1,90 |
95,27 ± 2,91 |
84,03 ± 7,31 |
|
Бк |
95,20 ± 3,19 |
89,33 ± 4,80 |
80,83 ± 10,75 |
88,45 ± 6,68 |
92,65 ± 3,95 |
|
|
CD44 |
Здоровые |
97,77 ± 1,05 |
98,27 ± 0,72 |
97,43 ± 2,57 |
96,63 ± 3,27 |
97,13 ± 1,53 |
|
Бк |
95,58 ± 1,58 |
97,40 ± 1,41 |
95,63 ± 1,74 |
96,60 ± 2,27 |
99,80 ± 0,12 |
|
|
CD105 |
Здоровые |
41,50 ± 3,57 |
55,77 ± 4,04 |
49,43 ± 6,67 |
70,60 ± 5,75 |
90,73 ± 0,59 |
|
Бк |
58,63 ± 3,43 |
86,63 ± 2,16 |
55,55 ± 4,33 |
90,78 ± 3,53 |
92,78 ± 1,07 |
|
|
CD73 |
Здоровые |
95,53 ± 4,22 |
99,83 ± 0,17 |
97,57 ± 1,37 |
98,87 ± 0,94 |
99,23 ± 0,62 |
|
Бк |
99,80 ± 0,12 |
99,93 ± 0,02 |
98,08 ± 0,61 |
97,20 ± 1,77 |
97,93 ± 1,04 |
|
|
CD13 |
Здоровые |
93,60 ± 3,00 |
90,13 ± 8,47 |
95,10 ± 4,25 |
93,43 ± 6,32 |
93,20 ± 6,55 |
|
Бк |
93,08 ± 6,47 |
91,73 ± 4,62 |
93,03 ± 2,48 |
96,50 ± 0,87 |
94,80 ± 1,93 |
Для определения исходного уровня протеинов в культуральной жидкости нами была проведена спектрометрия среды для культивирования. По результатам анализа масс-спектра среды для культивирования были выделены 5 перекрывающихся зон с наибольшей концентрацией белковых фрагментов (далее кластеры): кластер 1 – от 0,8 кДа до 3,3 кДа; кластер 2 – от 3,3 кДа до 6,00 кДа; кластер 3 – от 6 кДа до 11 кДа; кластер 4 – от 11 кДа до 16,6 кДа; кластер 5 – более 16,6 кДа.
При сравнительном анализе протеинового профиля интактной среды для культивирования и культуральной жидкости мы получили критерии оценки метаболической активности клеток. Так как содержание протеиновых фрагментов в интактной среде априори величина постоянная и колебаться может лишь в незначительных пределах, мы предположили, что только активность клеток может изменять этот показатель. Если процент протеиновых фрагментов культуральной жидкости в каком-либо кластере превышает аналогичный параметр по интактной среде – клетки, по нашему мнению, синтезируют компоненты в среду в означенном масс-спектральном диапазоне, в противоположной ситуации – используют.
Сравнительный анализ культуральной жидкости фибробластов условно-здоровых детей от различных пассажей (рис. 1) показал, что в пассаже А статистически значимой разницы между показателями среды и культуральной жидкостью не было, что можно объяснить относительно низкой метаболической активностью клеток в адаптационном периоде. Активность клеток в пассажах Б, В, Г и Д была значительно выше, причем в кластерах 1 и 5 было зарегистрировано превышение над показателями среды: в пассаже В (p = 0,03) и Г (p = 0,04) – кластер 1 и пассаж Б (p = 0,04), В (p = 0,03) и Д (p < 0,02). В кластерах 2, 3, 4 протеиновых фрагментов было зарегистрировано меньше, чем в интактной среде (p < 0,03).
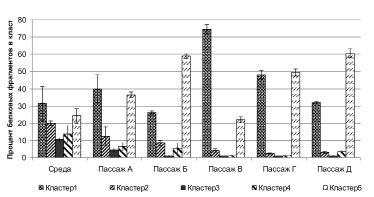
Рис. 1. Содержание протеиновых фрагментов в культуральной жидкости культур фибробластов условно здоровых детей
Анализ культуральных жидкостей культур фибробластов детей с болезнью Крона (рис. 2) показал, что клетки проявляют повышенную активность в продукции компонентов уже в пассаже А в кластере 1 (p = 0,03). В пассажах Б, В и Д превышение над показателями среды было зафиксировано только в кластере 5 (p < 0,05).
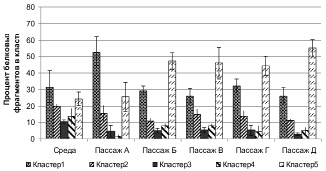
Рис. 2. Содержание протеиновых фрагментов в культуральной жидкости культур фибробластов детей с болезнью Крона
В 3 и 4 процент протеиновых фрагментов был значительно ниже в интактной среде (p < 0,03).
Приведенные соотношения привели нас к мысли о возможных различиях между протеиновыми профилями культуральных жидкостей детей с болезнью Крона и условно здоровых детей. Для проверки этой гипотезы был проведен сравнительный анализ протеиновых профилей культуральных жидкостей детей с болезнью Крона с протеиновыми профилями культуральных жидкостей условно здоровых детей (рис. 3).
В пассаже А статистически значимых различий в протеиновых профилях больных и условно здоровых выявить не удалось. В пассаже Б значения коэффициента больше единицы зафиксированы в кластере 3 (p = 0,04), в пассажах В и Г статистически значимые различия обнаружены в кластерах: 2 (p = 0,04 только в пассаже Г), 3 (p = 0,04 в обеих выборках) и 4 (p = 0,02 и p < 0,02 соответственно), в пассаже Д статистически значимых различий нами обнаружено не было. Подобную разницу в метаболической активности можно объяснить активным участием фибробластов в патологических процессах. По данным других авторов, метаболический профиль клеток (т.е. спектр и активность продукции ими различных веществ) может меняться под воздействием различных факторов и патогенов. Так, например, в условиях инсулинорезистентности и гипергликемии, наиболее характерных для сахарного диабета второго типа, фибробласты трансформируются в своих предшественников и начинают бесконтрольно синтезировать коллаген, эластин, протеогликаны и другие компоненты экстрацеллюлярного матрикса, что приводит к развитию активной перестройки соединительной ткани и изменению сосудистой стенки [2]. Протеиновые профили культур фибробластов меняются и при других патологических состояниях – при пневмонии [8] или вирусной инфекции [5]. Косвенно о внешней природе фактора, влияющего на изменение протеинового профиля фибробластов при патологии, может свидетельствовать тот факт, что к пассажу Д коэффициент отношения протеиновых профилей детей с БК и условно-здоровых приближается к единице. Можно предположить, что в процессе замены культуральной среды при пассировании количество фактора, «стимулирующего» патологическое поведение фибробластов, снижается, и они постепенно возвращаются к нормальному режиму функционирования.
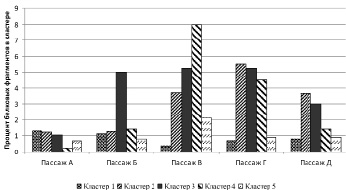
Рис. 3. Отношение процентного содержания протеиновых фрагментов в культуральной жидкости от пациентов с БК к условно-здоровым
Выводы
1. Масс-спектр культуральной жидкости культур фибробластов детей c болезнью Крона имеет характерные особенности, отличающие его от масс-спектра культуральной жидкости культур фибробластов, полученных от условно здоровых детей.
2. Различия между протеомным профилем культуральной жидкости культур фибробластов, полученных от детей с болезнью Крона и от условно здоровых детей, уменьшаются с увеличением сроков культивирования.
3. Молекулярные сигнатуры культуральной жидкости отличаются от масс-спектров интактной культуральной среды, что может быть использовано для характеристики активности культур фибробластов на разных этапах культивирования.
Библиографическая ссылка
Кропотов В.С., Васильева Е.А., Маянская И.В., Ашкинази В.И., Колесов С.А. СЕКРЕТОМ ДЕРМАЛЬНЫХ ФИБРОБЛАСТОВ У ДЕТЕЙ С БОЛЕЗНЬЮ КРОНА // Международный журнал прикладных и фундаментальных исследований. – 2014. – № 11-2. – С. 283-286;URL: https://applied-research.ru/ru/article/view?id=6120 (дата обращения: 20.04.2024).

