Йодсодержащие тиреоидные гормоны участвуют в регуляции многих метаболических процессов, в том числе и энергетического обмена, активности процесса липопероксидации и, соответственно, антиоксидантной защиты. Также они повышают чувствительность к катехоламинам, системное артериальное давление, частоту и силу сердечных сокращений, двигательную активность, температуру тела, уровень глюкозы в крови, усиливают глюконеогенез, в печени тормозят синтез гликогена, усиливают липолиз, оказывают влияние на белковый обмен и многое другое. Исходя из того, что тиреоидные гормоны выступают в роли одного из главных регуляторов энергетического обмена, мы посчитали необходимым провести исследования по изучению их влияния на активность процесса липопероксидации и антиоксидантную защиту. Свободные радикалы являются одним из ведущих факторов повреждения клеток организма, а адекватность защитных механизмов поддерживает их нормальное функционирование.
Ранее в нашей лаборатории изучалась антиоксидантная защита и пероксидация липидов при экспериментальных гипер- и гипокальциемиях [1, 2], созданных на крысах путем перорального введения больших доз витамина D и оперативного удаления паращитовидных желез. Было показано, что как гиперкальциемия, так гипокальциемия усиливают пероксидацию липидов с повышением содержания гидроперекисей и малонового диальдегида и одновременным ослаблением антиоксидантной защиты со снижением активности супероксиддисмутазы и каталазы.
Цель исследования
Изучить активность перекисного окисления липидов, состояние антиоксидантной защиты и морфологическую характеристику сердечно-сосудистой системы у крыс с экспериментальными гипер- и гипотиреозом.
Материалы и методы исследования
Опыты были поставлены на 64 крысах-самках линии Wistar массой 180–270 г, разделенных на три группы. Первую составляли крысы с экспериментальным гипертиреозом, создаваемым ежедневным введением через зонд в желудок левотироксина натрия на протяжении 14 суток в дозе 5,0 мкг/100 г [3], разведённого в 1 мл водопроводной воды. На крысах второй группы была создана модель гипотиреоза, ежедневным внутрижелудочным введением тиамазола в дозе 1,2 мг/100 г [6], также разведённом в 1 мл водопроводной воды, но более продолжительно (21 день) для большего истощения запасов ранее синтезированных гормонов щитовидной железы и блокировки образования новых. Третью группу составляли интактные крысы, аналогично опытным, получавшие такой же объем воды.
По окончании опытов осуществляли забор крови из сердца крыс, находящихся в состоянии обезболивания предварительным внутрибрюшинным введением золетила – анестетика общего действия в дозе 1,0 мл/кг.
Об интенсивности перекисного окисления липидов судили по накоплению первичных (гидроперекиси в плазме крови) и вторичных (малоновый диальдегид в мембране эритроцитов) липидных радикалов в остатках полиненасыщенных жирных кислот. О состоянии антиоксидантной системы судили по активности внутриклеточных ферментов: гемсодержащей каталазы, способной восстанавливать перекись водорода до воды, и супероксиддисмутазы, защищающий клетку от повреждающего действия супероксидного радикала (O2−), хотя эффект этого фермента проявляется и внеклеточно (третий тип, содержащий медь в активном центре и цинк как структурный компонент. Исследуемые показатели определялись спектрофотометрически по общепринятым методикам [4].
О состоянии сердечно-сосудистой системы судили по морфологической картине при световой микроскопии после фиксации материала в 10 %-м растворе формалина, приготовления срезов толщиной 6–8 мкм и окраски гематоксилин-эозином.
Полученные результаты статистически обрабатывались с применением параметрического метода сравнения средних величин (М ± m) контрольных и опытных значений, а степень достоверности оценивалась по t-критерию Стьюдента.
Содержание крыс, уход, постановка опытов и вывод их из эксперимента, с последующей утилизацией, осуществлялись в соответствии с приказом Минздравсоцразвития России № 708н от 23 августа 2010 г. «Об утверждении Правил лабораторной практики».
Результаты исследования и их обсуждение
При завершении исследований в группе крыс с экспериментальным гипертиреозом концентрация свободного трийодтиронина составила 5,6 ± 0,43 пмоль/л (р < 0,005), а тетрайодтиронина – 27,72 ± 2,56 пмоль/л (р < 0,001). При этом у контрольных животных уровни этих гормонов были 3,89 ± 0,26 пмоль/л и 18,63 ± 1,76 пмоль/л соответственно, что говорит о том, что модель с усиленным образованием гормонов щитовидной железы была достигнута.
Относительно данных контрольной группы крыс было выявлено усиление процессов пероксидации липидов: уровня гидроперекисей липидов в плазме крови с 5,13 ± 0,3 мкмоль/л до 6,34 ± 0,24 мкмоль/л (p < 0,001); содержания малонового диальдегида в эритроцитах с 35,5 ± 0,96 мкмоль/л до 48,26 ± 3,7 мкмоль/л (p < 0,005). Одновременно отмечалось увеличение в эритроцитах активности ферментов (p < 0,001): каталазы с 2,6 ± 0,125х10-4МЕ/1г Hb (контроль) до 6,64 ± 0,27х10-4МЕ/1г Hb; супероксиддисмутазы с 69,93 ± 1,18 ед. ингиб. (контроль) до 78,94 ± 0,89 ед. ингиб. (рис. 1).
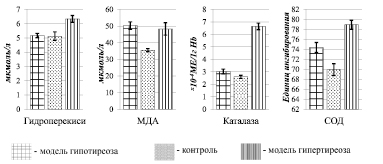
Рис. 1. Соотношения продуктов перекисного окисления липидов и ферментов антиоксидантной защиты у крыс в разных экспериментальных группах
В группе крыс с экспериментальным гипотиреозом средняя концентрация свободного трийодтиронина составила 2,3 ± 0,21 пмоль/л, а тетрайодтиронина – 3,2 ± 0,18 пмоль/л, что статистически значимо (р < 0,001) отличалось от контроля. Относительно других изучаемых показателей было выявлено следующее: тенденция к повышению активности каталазы (p > 0,05) до 3,025 ± 0,19х10-4МЕ/1г Hb и достоверное (p = 0,01) увеличение до 74,38 ± 1,01 ед. ингиб. активности супероксиддисмутазы. Уровень малонового диальдегида также статистически значимо (р < 0,001) увеличился до 50,33 ± 1,2 мкмоль/л, а в содержании гидроперекисей липидов (5,17 ± 0,15 мкмоль/л) не было выявлено изменений (рис. 1).
Другие исследователи, как отечественные [5], так и иностранные [7, 9,1 0], изучавшие особенности перекисного окисления липидов при различных нарушениях функции щитовидной железы, показали как повышение содержания малонового диальдегида [5, 7, 10] и активности супероксиддисмутазы [5, 9], каталазы и глутатионпероксидазы с одновременным нарушением некоторых биохимических показателей печени при гипотиреозе [9], так и снижение антиоксидантной защиты при гипертиреозе [9].
В проведенных морфологических исследованиях после 21-дневного создания экспериментального гипотиреоза наблюдался выраженный интерстициальный отёк миокарда, инфильтрация лимфоцитами и плазматическими клетками с примесью эозинофилов (рис. 2, А). Практически весь объём кардиомиоцитов пребывал в состоянии крупнокапельной жировой дистрофии (рис. 2, Б). Встречались участки атрофии с развитием фиброза (рис. 2, В). Также наблюдалось поражение эндотелия сосудов с его набуханием (рис. 2, Г).
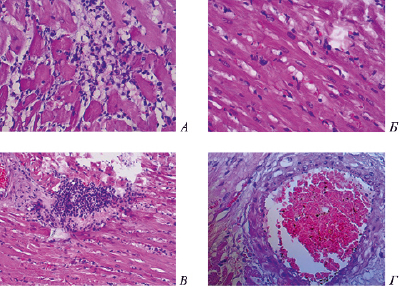
Рис. 2. Морфология миокарда крыс с экспериментальным гипотиреозом. Окраска гематоксилин-эозин (х400 и х200)
При экспериментальном гипертиреозе видимых морфологических изменений в большинстве микропрепаратов выявлено не было. Интерстициальный отёк и инфильтрация не обнаружены. Жировая дистрофия также не наблюдалась. Эндотелий сосудов не изменен. Но в отдельных случаях обнаруживалось его небольшое набухание.
Полученные нами результаты перекликаются с данными Duntas L.H., Chiovato L. [8], показавшими, что у кардиологических больных вероятность ухудшения состояния наблюдается даже при слабовыраженном гипотиреозе.
Заключение
В экспериментальных моделях как левотероксинового гипертиреоза, так и тиамазолового гипотиреоза обнаружено усиление перекисного окисления липидов, сопровождающееся повышением активности ферментов антиоксидантной защиты, особенно при гипертиреозе. В то же время при гипотиреозе морфологические изменения в миокарде и его сосудах были более выражены, что, возможно, в большей степени увеличивает риск развития заболеваний сердечно-сосудистой системы.

