Процессы раннего развития ЦНС животных и человека всегда были в центре внимания биологов и медиков. Именно в этот период происходят наиболее важные события, касающиеся будущей судьбы отделов ЦНС, нарушение формирования которых драматически сказываются на всей дальнейшей судьбе организма [1, 2]. Появление в последние годы новых методов исследования нервной системы (иммуногисто- и цитохимия, электронная и конфокальная микроскопия, геномный анализ и др.) привели к существенным изменениям во взглядах на процессы формирования нервной системы в пре- и постнатальных периодах развития организма позвоночных животных и человека. Особое внимание заслуживают данные по экспериментальным моделям изучения нейрогенеза во взрослом мозге в норме и после травмы [3, 4].
Представлен краткий обзор собственных исследований и данных литературы о проблемах пре- и постнатального развития нервной системы позвоночных животных. Особое внимание уделено вопросам репарации нервной системе в условиях травмы.
Особенности пренатального развития нервной системы
Пренатальное развитие ЦНС человека обычно разделяют на эмбриональный (первые 8 недель) и фетальный периоды (с 9 недели до рождения) [1, 5]. В процессе формирования нервной пластинки и нервной трубки на клетки первичного эпителия действует большое количество сигнальных молекул: хордин (chordin), ноггин (noggin) и фоллистатин (follistatin), индуцирующих процесс образования нейроэпителия и нейрональных стволовых клеток (НСК), из которых будут формироваться все элементы нервной ткани. Особо следует отметить регуляторные белки из семейства BMP, которые влияют на разнообразные процессы в развивающемся мозге: пролиферацию региональных стволовых клеток и их потомков; клеточную гибель; миграцию и дифференцировку НСК, а также определяют градиент ростро-каудального и дорсо-вентрального развития ЦНС [5, 6].
Нейральные стволовые клетки активно делятся и в процессе прохождения клеточного цикла претерпевают сложные превращения, связанные с последовательным перемещением ядросодержащей части клетки по отросткам, получившие наименование – интеркинетическая ядерная миграция. В результате формируется одно из первых структурных образований развивающейся стенки нервной трубки – вентрикулярный слой или зона (VZ). Наиболее важным для развития мозга является фактор-SHH (sonic hedgehog), направляющий дифференцировку НСК в сторону нейронного дифферона и регулирующий развитие вентральных отделов нервной трубки. Дорсальную часть нервной трубки (крыловидную пластинку) контролируют морфогенетические белки BMP4 и MBP7, секретируемые клетками эктодермы и ряд других ростовых и транскрипционных факторов (Pax 3,4,6), FGF8 – фактор роста фибробластов, GDNF – нейротрофический фактор глии, BDNF, NT3,4 – нейротрофические факторы мозга и др.). SHH контролирует разделение вентральных отделов переднего мозгового пузыря на медиальный (MGE) и латеральный (LGE) ганглионарные гребни, НСК которых формируют популяции нейронов, мигрирующие в подкорковые и корковые отделы полушарий конечного мозга. Относительно недавно было установлено, что некоторые нейротрофины (BDNF, NT-3 и NT-4) способны поддерживать как пролиферацию, так и плюрипотентность НСК клеток [6, 7].
В настоящее время показано, что популяции клеток, составляющих вентрикулярный (VZ) и формирующийся несколько позднее субвентрикулярный (SVZ) слои, неоднородны. В зависимости от присутствия у клеток отростков и характера их контакта с поверхностями стенки мозга выделяют три класса клеток предшественников: монополярные, биполярные и неполярные. Биполярные клетки (или апикальные предшественники АР) – представляют собой либо НСК клетки, либо клетки так называемой радиальной глии (RG), в которые НСК превращаются на самых ранних этапах нейрогенеза. Монополярные предшественники появляются на более поздних стадиях, когда в стенке мозга формируется субвентрикулярный (SVZ) слой, содержащий так же как и вентрикулярный слой НСК. Во внутренних слоях субвентрикулярной зоны у человека недавно были обнаружены клетки предшественники с неполярной морфологией. Характерной чертой этих клеток является ретракция отростков перед митозом и потеря их контакта с апикальной и базальной поверхностью стенки мозга. Они получили наименование – базальные предшественники (ВР) [2, 5].
Фактически мы имеем дело с двумя путями образования нейронов в развивающемся мозге. Это путь прямого нейрогенеза, когда источником нейробластов являются непосредственно НСК и нейрогенная радиальная глия (RG), т.е. апикальные предшественники с моно- или биполярной морфологией, и путь непрямого нейрогенеза, когда источником нейробластов служат промежуточные нейрональные предшественники, являющиеся потомками клеток радиальной глии, т.е. базальные предшественники. Непрямой путь нейрогенеза может выступать в роли быстрого увеличения количества нейронов в условиях ограниченного времени (каждое асимметричное деление радиальной глии через стадию промежуточного нейронального предшественника может давать два-четыре нейрона) и тем самым регулировать площадь и толщину стенки мозга [8].
Формирование отделов мозга находится под контролем так называемых «вторичных организаторов» – групп клеток, синтезирующих ряд морфогенетических и транскрипционных факторов, градиент концентрации которых определяет направление миграции и дифференцировки нейронов в разных структурах мозга (таблица).
Гены и продукты их экспрессии, контролирующие различные процессы развития отделов и структур головного мозга (по: 2, 3, 6, 9)
|
Ген |
Место экспрессии |
Функция |
|
Dlx1 Dlx 2, Dlx 5 |
Субпаллиум (ганглионарные возвышения), промежуточный мозг |
Миграция субпаллиальных нейробрастов, миграция нейронов в кору из ганглионарных возвышений переднего мозгового пузыря |
|
Emx 1, Emx 2 |
Конечный мозг |
Пролиферация клеток в развивающемся мозге, миграция нейробластов |
|
Lhx 1, Lhx 2, Lhx 5 |
Передний мозг, кора полушарий |
Формирование подкорковых и корковых (архикортекс) отделов полушарий |
|
Nkx 2,1 Nkx 2,2 |
Вентральные отделы полушарий |
Пролиферация и миграция нейробластов в стриатуме |
|
Otx 1, Otx 2 |
Передний мозг, средний мозг, передние отделы ствола мозга |
Формирование структуры полушарий, включая кору мозга |
|
Pax 3, Pax 6 |
Передний мозг |
Миграция нейробластов в дорсальных отделах полушарий |
На более поздней стадии развития формирование зачатков больших полушарий млекопитающих и человека происходит одновременно с развитием так называемого медиального (MGE), латерального (LGE) и каудального (CGE) ганглионарных возвышений, расположенных в вентральных отделах полушарий. Данные структуры принимают участие не только в развитии подкорковых структур полушарий, но и участвуют в формировании нейронных популяций коры. В это же время продолжаются активные процессы нейрогенеза в структурах других отделов головного и спинного мозга.
Таким образом, современные исследования процессов раннего нейрогенеза в ЦНС животных и человека позволили сделать ряд заключений, существенно дополняющих прежние представления о развитии мозга:
– в период эмбрионального развития популяция нейронов формируется из разных источников: в первый период эмбрионального развития – из НСК нейрогенного эпителия за счет вертикальной миграции в стенке мозга, а ближе к рождению – из их более поздних потомков – клеток так называемой радиальной глии. Клетки радиальной глии могут продуцировать не только клетки – предшественники нейронов, но и напрямую постмитотические нейроны, составляющие в дальнейшем большую часть нейронной популяции в ряде отделов мозга (в частности, при формировании коры головного мозга и мозжечка);
– найден целый ряд иммунногистохимических маркеров, которые позволяют более или менее надежно идентифицировать НСК и их потомков. Среди них следует отметить: ядерный антиген нервных клеток (нейрогенин) – NeuN; ядерный маркер нейрональной дифференцировки (HuCD), маркер нейробластов – даблкортин (DCX); нейрон-специ- фическую энолазу – NSE; молекулы адгезии нервных клеток – PSA-NCAM; цитоскелетные белки – нестин, β-тубулин III; транскрипционные факторы – Sox-1, Sox-2, Dlx2, Pax 6, ароматаза В (AroB) и ряд других [4, 10].
– на пролиферацию и дифференцировку клеток нейрональных предшественников действует большое количество разнообразных ростовых, нейротрофических и транскрипционных факторов;
– большая часть интернейронов мозга (до 40–70 %) мигрируют тангентально, беря начало в герминативных зонах (LGE, MGE и CGE), расположенных достаточно далеко в вентральных отделах полушарий. Было показано, что они продуцируют разные субпопуляции нейронов, мигрирующие в разные районы паллиума и субпаллиума [2, 8].
Особенности взрослого нейрогенеза в ЦНС животных и человека
В настоящее время установлено, что в структурах взрослого мозга позвоночных животных и человека в течение длительного времени сохраняются участки нейрогенной активности. У млекопитающих они обнаружены в субвентрикулярной зоне (SVZ) в районе латеральных мозговых желудочков полушарий конечного мозга и в субгранулярной зоне (SGZ) гиппокампа [3, 11]. У низших позвоночных нейрогенные зоны обнаружены в нескольких отделах мозга [4, 12]. Проведенные в этом направлении исследования позволили сделать ряд общих выводов относительно особенностей постнатального нейрогенеза в ЦНС позвоночных животных:
– нейрональные стволовые клетки и их потомки (RG-клетки) находятся в тесном взаимодействии со многими элементами окружающей их структуры мозга, формируя вместе с ними своеобразные – нейрогенные ниши (neuronal stem niche) [3, 4, 13];
– клетки нейрогенных ниш выделяют ряд факторов (нейромедиаторы, газообразные субстанции NO, CO, H2S и др.), которые по принципу ауто- и паракринной секреции влияют на процессы пролиферации, дифференцировки, миграции, рост аксонных и дендритных ветвлений нейрональных предшественников и их потомков [4, 6, 7];
– на основную роль нейрогенных предшественников во взрослом мозге претендуют клетки радиальной глии – RG, популяция которых сохраняется в постнатальном периоде развития длительное время. Специфическим маркером RG является AroB, однако в ней также выявляется активность TH-тирозингидроксилазы, NADPH-диафоразы, GABA – гамма-аминомасляной кислоты и NuCD – протеина (традиционно нейрогенных маркеров). Это является уникальным явлением, позволяющим выделить линии глиальной и нейронной дифференцировки при развитии мозга (рисунок);
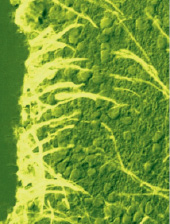
Иммуногистохимическое выявление ароматазы В в клетках радиальной глии в субвентрикулярной области промежуточного мозга взрослого лосося – симы Onchorhinchus masou Br. [4, 13]
– образовавшиеся в нейрогенных нишах нейробласты и глиобласты мигрируют в разные отделы мозга, иногда довольно далеко от мест их образования (в обонятельную луковицу, гиппокамп, стриатум, мозжечок и даже в кору больших полушарий);
– взрослый нейрогенез у млекопитающих со временем ослабевает;
– у низших позвоночных (амфибий, рыб) процесс постнатального нейрогенеза протекает в течение длительного времени и имеет, как много общего с таковым у млекопитающих, так и ряд специфических черт [4, 12].
Нейрогенез во взрослом мозге в условиях травмы мозга
После установления факта взрослого нейрогенеза в ЦНС позвоночных животных и человека наибольший интерес вызывает вопрос о возможностях пролиферативных ниш мозга в восстановлении структуры мозга после травмы. На модельных объектах (костистых рыбах) нами были проведены исследования реакции мозга на механическую травму (разрез) структур ЦНС (крыша среднего мозга, мозжечок, конечный мозг) с использованием методов иммуногистохимии, конфокальной и электронной микроскопии [4, 7, 13]. В результате этих экспериментов было показано:
– при механическом повреждении разных отделов мозга выявлено усиление пролиферативной активности как в традиционных пролиферативных зонах нейрогенеза (перивентрикулярные области нейрогенных ниш), так и зафиксировано появление новых нейрогенных участков и зон вторичного нейрогенеза;
– процесс репарации начинается с апоптоза поврежденных элементов нервной ткани. Апоптотический ответ наблюдается уже через полчаса после нанесения повреждающего воздействия и продолжается до 21 дня после нанесения травмы. Это подтверждается результатами маркирования TUNEL-позитивных фрагментов ДНК в зоне повреждения (зрительного нерва), а также данными электронно-микроскопического анализа;
– прижизненный мониторинг клеток в зоне повреждения с помощью мультифотонной конфокальной микроскопии показал, что уже через час после повреждающего воздействия наблюдается физиологический ответ со стороны микроглии (макрофагов мозга), которые мигрируют в область нанесения механической травмы и активно участвуют в элиминации поврежденных клеток с помощью фагоцитоза;
– в отличие от млекопитающих, воспалительная реакция в нервной ткани у низших позвоночных животных (рыб) угасает, не формируя характерный глиальный рубец. Было обнаружено, что NO, секретируемая клетками нейрогенных ниш, оказывает проаптогенное и нейропротективное действие в зоне травмы мозга, регулируя уровень кальция, снижая выработку супероксидов и блокируя токсическое действие глутамата;
– дифференцировка клеток в нейрональном направлении, обнаруженная при помощи маркирования клеток антителами против белка HuC/D, происходила в пролиферативных зонах теленцефалона, зрительного тектума, мозжечка и продолговатого мозга форели уже через 2 дня после травмы;
– использование низших позвоночных, как модельных объектов представляется весьма перспективным для изучения регенеративных потенций нервной ткани, как в норме, так и при патологии [4, 11, 14, 15].
Заключение
Полученные данные послужат основой для дальнейших исследований особенностей пре- и постнатального нейрогенеза в ЦНС животных и человека в норме и при патологии.
Работа выполнена при финансовой поддержке гранта Президента РФ (МД-4318.2015.4) и Программы фундаментальных исследований ДВО РАН «Дальний Восток» на 2015–2017 гг. (проект № 15-I-6-116, раздел III).

