Патогенные и симбиотические взаимодействия растений с различными группами микроорганизмов часто встречаются в природе и во многом схожи. Они основываются на подавлении или преодолении защитных механизмов растений, что способствует успешной колонизации их клеток. Растения способны реагировать на различные сигналы из внешней среды, приспосабливаясь к ним при помощи генетического аппарата. В свою очередь бактерии, взаимодействуя с растением-хозяином, способны создавать для себя благоприятные условия. В литературе имеются данные о том, что одним из механизмов запуска сигнальных реакций у растений является аденилатциклазная сигнальная система, когда под влиянием различных биотических факторов активируется трансмембранная аденилатциклаза, что вызывает резкое и кратковременное увеличение уровня циклического аденозинмонофосфата [1, 2].
Целью настоящей работы было в краткосрочных опытах изучить влияние клубеньковых и патогенных бактерий на отдельные компоненты аденилатциклазной сигнальной системы (цАМФ, рАЦ и тАЦ).
Материалы и методы исследования
Исследования проводили на проростках гороха (Pisum sativum L.) сорта Рондо, выращенных в термостате при температуре 22 °С, у которых в течение часа с интервалом в 10 минут определяли содержание цАМФ, а также активность растворимой и трансмембранной форм аденилатциклазы. В качестве контроля применяли нулевой отрезок времени. Для экспериментов использовали растения, выращенные на воде без инокуляции, а также инокулированные клубеньковыми и патогенными бактериями. Для инокуляции использовали 2 штамма бактериями Rhizobium leguminosarum bv. viceae: эффективный производственный (CIAM 1022), который характеризуется умеренной способностью проникать в корни растений, образуя при этом развитые клубеньки, фиксирующие азот; неэффективный производственный (CIAM 1064), отличающийся более агрессивной способностью колонизировать корневую систему растения-хозяина, что на заключительном этапе формирования бобово-ризобиального симбиоза приводит к образованию большого числа недоразвитых клубеньков, не способных к эффективной азотфиксации; и 1 штамм патогена гороха Pseudomonas syringae pv. pisi, вызывающий бактериальный ожог.
Активность компонентов аденилатциклазной сигнальной системы определяли по методу, основанному на работе [3]. Для этого корни фиксировали в жидком азоте и гомогенизировали в среде выделения, содержащей 0,02 М фосфатный буфер, рН 7,2; 0,1 мМ теофиллин; 1 мМ дитиотреитол; 50 мкг/мл фенилметилсульфонилфторид; 50 мкг/мл гидроксимеркурийбензоат; 1 мкг/мл лейпептин. Затем гомогенат центрифугировали 20 мин при 16 000 g («Allegra 64 R»). Полученный супернатант центрифугировали 90 мин при 105 000 g («Sorvall Discovery 90 SE»). Полученный осадок ресуспендировали и определяли в нем активность трансмембранной аденилатциклазы (тАЦ), а в супернатанте – активность растворимой аденилатциклазы (рАЦ) и концентрацию циклического аденозинмонофосфата (цАМФ). Активность аденилатциклаз оценивали по концентрации цАМФ в пробе в пересчете на 1 мг белка. Концентрацию цАМФ определяли иммуноферментным анализом (ELISA). Белок определяли по методу Брэдфорда.
Эксперименты проводили в 3 независимых повторениях. Для лучшего восприятия результаты представлены в процентах от контроля. Достоверность различий оценивали по критерию Стьюдента.
Результаты исследования и их обсуждение
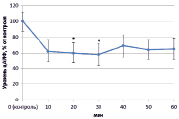
При выращивании проростков гороха на воде наблюдали снижение уровня цАМФ на протяжении всего эксперимента в среднем на 35–40 % (рис. 1, А).
А) Б)
В) Г)
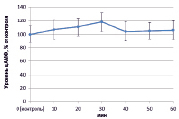
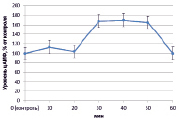
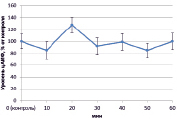
Рис. 1. Динамика уровня цАМФ в корнях проростков гороха: А) выращенных на воде; Б) инокулированных Rhizobium leguminosarum bv. viceae (CIAM 1022); В) инокулированных Rhizobium leguminosarum bv. viceae (CIAM 1064) и Г) зараженных Pseudomonas syringae pv. pisi. Примечание. * – различия достоверны при р ≥ 0,95; ** – различия достоверны при р ≥ 0,99; *** – различия достоверны при р ≥ 0,999; не помеченные «*» – различия не достоверны
При добавлении в среду инкубации клубеньковых бактерий эффективного производственного штамма (CIAM 1022) ярко выраженных изменений в концентрации цАМФ не наблюдалось (рис. 1, Б). В свою очередь на фоне инокуляции неэффективным производственным штаммом Rhizobium leguminosarum bv. viceae (CIAM 1064) в период 30–50 минут происходило значительное увеличение уровня цАМФ (на 70 %) (рис. 1, В). При заражении Pseudomonas syringae pv. pisi цАМФ оставался на уровне контроля, за исключением периода 20 минут, когда наблюдалось его увеличение на 30 % (рис. 1, Г).
Из литературы известно, что увеличение концентрации цАМФ внутри клеток при стрессе носит защитный характер и способствует активации соответствующих защитных реакций [2]. В связи с этим повышение концентрации цАМФ под влиянием неэффективного штамма ризобий вполне логично и является механизмом, предотвращающим избыточную колонизацию корневой системы растения-хозяина. Пониженный уровень цАМФ при инокуляции эффективным штаммом клубеньковых бактерий, возможно, также выполняет регуляторную функцию, поскольку уменьшение цАМФ в клетке не приводит к запуску защитных реакций и позволяет ризобиям колонизировать клетки корня. Относительно взаимодействия с PS можно полагать, что пониженный уровень цАМФ свидетельствует о степени вирулентности патогена.
Так как основным источником циклического аденозинмонофосфата является аденилатциклаза, в дальнейших исследования изучали не только уровень цАМФ, но и активность синтезирующих его ферментов (тАЦ и рАЦ).
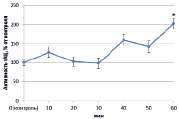
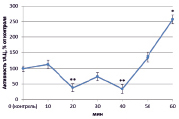
Изучив активность трансмембранной аденилатциклазы (тАЦ), можно сказать, что во всех вариантах наблюдалась тенденция к увеличению активности изучаемого фермента к 60 минутам (рис. 2).
Наибольшее увеличение было вызвано неэффективным штаммом клубеньковых бактерий (650 %) (рис. 2, В), в остальных же вариантах изменение активности составило 100–150 %.
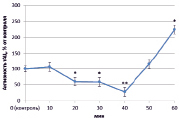
А) Б)
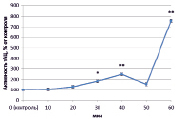
В) Г)
Рис. 2. Динамика активности тАЦ в корнях проростков гороха: А) выращенных на воде; Б) инокулированных Rhizobium leguminosarum bv. viceae (CIAM 1022); В) инокулированных Rhizobium leguminosarum bv. viceae (CIAM 1064) и Г) зараженных Pseudomonas syringae pv. pisi. Примечание. * – различия достоверны при р ≥ 0,95; ** – различия достоверны при р ≥ 0,99; *** – различия достоверны при р ≥ 0,999; не помеченные «*» – различия не достоверны
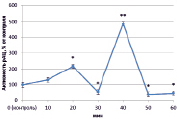
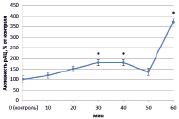
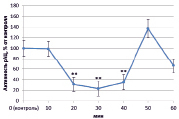
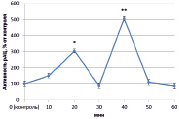
В динамике растворимой аденилатциклазы (рАЦ) в норме также определены ритмичные изменения, которые проявлялись в увеличении активности через 20 и 40 минут (на 127 % и 386 % соответственно) и снижении ее до уровня ниже контрольного через 30 и 50 минут на 50 % в обоих случаях (рис. 3, А). Как и в эксперименте с тАЦ, активность рАЦ при взаимодействии с патогеном практически совпадала с контролем (рис. 3, Г). Наибольшие различия наблюдались при инокуляции клубеньковыми бактериями. Так, при взаимодействии с эффективным штаммом ризобий преобладала тенденция к увеличению активности рАЦ, которая к концу эксперимента выросла почти на 350 % (рис. 3, Б). Неэффективный штамм в свою очередь вызывал снижение активности в интервале от 20 до 40 минут (на 50 %) (рис. 3, В).
А) Б)
В) Г)
Рис. 3. Динамика активности рАЦ в корнях проростков гороха: А) выращенных на воде; Б) инокулированных Rhizobium leguminosarum bv. viceae (CIAM 1022); В) инокулированных Rhizobium leguminosarum bv. viceae (CIAM 1064) и Г) зараженных Pseudomonas syringae pv. pisi. Примечание. * – различия достоверны при р ≥ 0,95; ** – различия достоверны при р ≥ 0,99; *** – различия достоверны при р ≥ 0,999; не помеченные «*» – различия не достоверны
Основываясь на данных литературы, можно сказать, что распознавание микросимбионта происходит с участием LysM-рецепторных киназ растения-хозяина, которые воспринимают сигналы от экзометаболитов микроорганизмов, в частности экзополисахаридов и Nod-факторов, позволяя сигнальным системам растения реагировать на биотические воздействия [1, 4, 5]. Так, аденилатциклазная сигнальная система, изменяя активность трансмембранной аденилатциклазы – основного источника цАМФ, регулирует метаболические реакции растения при биотических стрессах [6].
Труднее объяснить активность рАЦ в клетках корня гороха. Так как данная форма фермента у растений функционирует во внутриклеточных компартментах, можно предположить, что регуляция ее активности осуществляется посредством внутриклеточного кальция, по аналогии с млекопитающими [2].
Известно, что сигнальные молекулы у растений функционируют взаимосвязанно, на основе чего их можно объединить в сигнальную сеть [7]. В отдельных работах указывается, что у растений под влиянием биотических стрессов источником первичных сигналов является цАМФ, поскольку доказано, что под влиянием бактериальных элиситоров в растениях повышается концентрация цАМФ, сопровождающаяся изменениями в концентрациях внутриклеточного Са2+, который в свою очередь может влиять на уровень оксида азота [6]. Поэтому в дальнейших исследованиях интересно будет изучить влияние экзогенного цАМФ на интенсивность флуоресценции оксида азота в норме и на фоне взаимодействия с клубеньковыми и патогенными бактериями.
Заключение
Таким образом, по результатам исследований можно отметить следующие закономерности.
1. Под влиянием симбиотических и патогенных бактерий у проростков гороха обнаружены внутриклеточные колебания в уровне циклического аденозинмонофосфата и активности растворимой и трансмембранной форм аденилатциклазы.
2. Можно предположить, что вышеописанные изменения отдельных компонентов аденилатциклазной сигнальной системы растения-хозяина (тАЦ, рАЦ и цАМФ) могут использоваться растениями в качестве кода для передачи сигнала о взаимодействующем факторе.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (молодежный грант № 18-34-00221 мол_а).

