В последние годы значительно увеличилось число воспалительных заболеваний мужских половых органов, вызванных условно-патогенными микроорганизмами, доминирующих в микробиоте урогенитального тракта, проявляющих патогенный потенциал при экстремальных условиях (стресс, переохлаждение, травмы, облучение, интоксикации) [1, 4].
Впервые термин «негонококковый уретрит» (НГУ) для обозначения случаев воспаления уретры, вызванных не гонококками, был предложен на симпозиуме Международного союза по борьбе с венерическими заболеваниями и трепонематозами (The International Union against the Veneral Diseases and Treponematoses) в Монте-Карло (Монако) в сентябре 1954 г. [5] и решением ВОЗ введен в международную медицинскую терминологию.
Негонококковые уретриты у мужчин до настоящего времени остаются трудно диагностируемой патологией в связи с широким спектром возможных этиологически значимых агентов, трудности их дифференцировки от представителей нормальной микрофлоры уретры, доказательством участия в воспалительном процессе и установления факторов, способствующих прогрессированию [12, 16, 13]. Медико-социальная значимость проблемы определяется тем, что негонококковые уретриты чаще встречаются у молодых людей репродуктивного возраста. Доказано, что 95,0 % мужчин 18-45 лет страдают хроническим воспалением предстательной железы вследствие перенесенного урогенитального заболевания, обусловленного патогенными или условно-патогеннными микроорганизмами. Эпидемиологическое и клиническое значение негонококковых уретритов заключается в повышении риска заболевания ВИЧ-инфекцией, генитальным герпесом, сифилисом, развитием осложнений (простатит, эпидидимит) [8, 7].
Формирование воспалительной симптоматики негонококковых уретритов связано не только с инфекцией, обусловленной Chlamydia trachomatis и/или Ureaplasma urealyticum, но и условно-патогенными грамположительными и грамотрицательными микроорганизмами: Escherichia coli, Enterococcus spp., Pseudomonas aeruginosa, Proteus spp. и др. Несмотря на то, что энтерококки являются представителями нормальной микрофлоры уретры, они все чаще расцениваются как возбудители инфекций мочевыводящих путей [3]. Энтерококки, ранее относимые к стрептококкам группы D – многочисленная группа бактерий рода Enterococcus, включает виды Е. faecalis, Е. faecium. E. faecalis продуцирует цитотоксин, вызывающий лизис эритроцитов, нейтрофилов. Штаммы E. faecalis, продуцирующие цитотоксин, проявляют высокую резистентность к антибактериальным препаратам [8]. E. faecalis способен длительно персистировать в мочеполовой системе, обладает высокой протеолитической активностью, гидролизирует коллаген, гемоглобин и другие белки [2].
Цель исследования: Видовая идентификация условно-патогенных микроорганизмов у пациентов с негонококковыми уретритами и оценка чувствительности к антибактериальным препаратам E. faecalis.
Материалы
и методы исследования
Нами проведено комплексное клинико-лабораторное обследование 1335 пациентов в возрасте от 18 до 45 лет (средний возраст 34,0±7,3 года) обратившихся в клинико-диагностическое отделение ФГБУ «УрНИИДВиИ» Минздрава России с установленным диагнозом негонококковый уретрит, ассоциированный с условно-патогенными микроорганизмами.
Критериями для постановки диагноза негонококковый уретрит, ассоциированный с условно-патогенными микроорганизмами являлись:
1. Отсутствие возбудителей инфекций, передаваемых половым путем (Neisseria gonorrhoeae, C. trachomatis, Trichomonas vaginalis, Mycoplasma genitalium, Herpes simplex, Cytomegalovirus);
2. Жалобы пациента (выделения из мочеиспускательного канала, зуд, рези, жжение, чувство дискомфорта в уретре, запах в области наружных половых органов);
3. Анамнестические данные (ранее перенесенные негонококковые уретриты, случайные половые связи, переохлаждения, злоупотребления алкоголем, хронические заболевания мочеполовой системы);
4. Наличие объективной клинической картины (выделения из канала, гиперемия кожи головки, гиперемия и отечность губок уретры, налет на головке полового члена);
5. Лабораторные данные: количество лейкоцитов более 4-5 в поле зрения при микроскопии мазков из уретры окрашенных метиленовым синим и по Граму; бактериологическое исследование, в котором рост условно-патогенных микроорганизмов определялся в концентрации 104 КОЕ/мл и выше.
Критерии включения в исследование – пациенты мужского пола в возрасте от 18 до 45 лет, подписавшие информированное согласие на участие в исследовании, наличие диагноза НГУ подтвержденного микроскопическим и микробиологическим методами.
Критерии исключения – возраст менее 18 лет и старше 46, наличие ИППП, острое течение воспалительного процесса в органах урогенитального тракта, другие инфекционные заболевания мочевыводящих путей (пиелонефрит, цистит и др.) Тяжелые соматические заболевания (сахарный диабет, лихорадка, эпилепсия, гипотиреоз и др.)
Материалом для бактериоскопического и бактериологического исследования служило отделяемое уретры. Взятие отделяемого уретры производилось одноразовым стерильным урогенитальным зондом и помещалось в пробирку с транспортной средой Amies (Италия). Идентификация микроорганизмов проводилась методом времяпролетной масс-спектрометрии (MALDI TOF MS) с помощью анализатора микроорганизмов VITEK MS MALDI-TOF (BioMerieux). Для каждого вида микроорганизмов сформирован характерный набор спектров белков 16-S РНК (биомаркеров), полученный на основе анализа не менее 50 масс-спектров этого вида. Экстракция белков осуществлялась на одноразовом слайде с использованием готового матрикса для VITEK MS. Интерпретация результатов проводилась с использованием базы данных VITEK MS, состоящей из расширенного классификатора спектров клинически значимых видов. Структурированная база данных позволяет быстро и точно идентифицировать микробиологические штаммы. Чувствительность микроорганизмов к антибактериальным препаратам оценивали с помощью тест систем на автоматическом анализаторе VITEK 2 (BioMérieux). При оценке результатов определения чувствительности бактерий использовали следующие показатели: чувствительные (S), умеренно резистентные или штаммы с промежуточной чувствительностью (I), резистентные (R). Для идентификации U. urealyticum и Mycoplasma hominis были использованы диагностические реагенты in vitro для микробиологических исследований с определением чувствительности к антибактериальным препаратам (включая наборы Mycoplasma IST, BIO RAD). Диагностика C. trachomatis, M. genitalium, Herpes simplex I и II типов, Cytomegalovirus, Human Papillomavirus 16/18 типа осуществлялась методом ПЦР с гибридизационно-флуоресцентной детекцией в режиме «реального времени» с использованием наборов реагентов «АмплиСенс Chlamydia trachomatis /Ureaplasma/ Mycoplasma genitalium/ Mycoplasma hominis Мультипрайм-FL», «АмплиСенс HSV/CMV-Мультипрайм-FL». «АмплиСенс ВПЧ ВКР скрин- титр-FL» (ЦНИИЭ Роспотребнадзора, Москва).
Результаты исследования
и их обсуждение
При исследовании микробной обсемененности передней уретры у 1335 пациента с негонококковыми уретритами, ассоциированными с условно-патогенными микроорганизмами, было установлено, что концентрация микроорганизмов превышала 104 КОЕ/мл и в ряде случаев доходила до 109 КОЕ/мл. Спектр и частота условно-патогенных микроорганизмов обследованных пациентов с негонококковыми уретритами, идентифицированных масс-спектрометрическим методом, представлены на рис. 1.
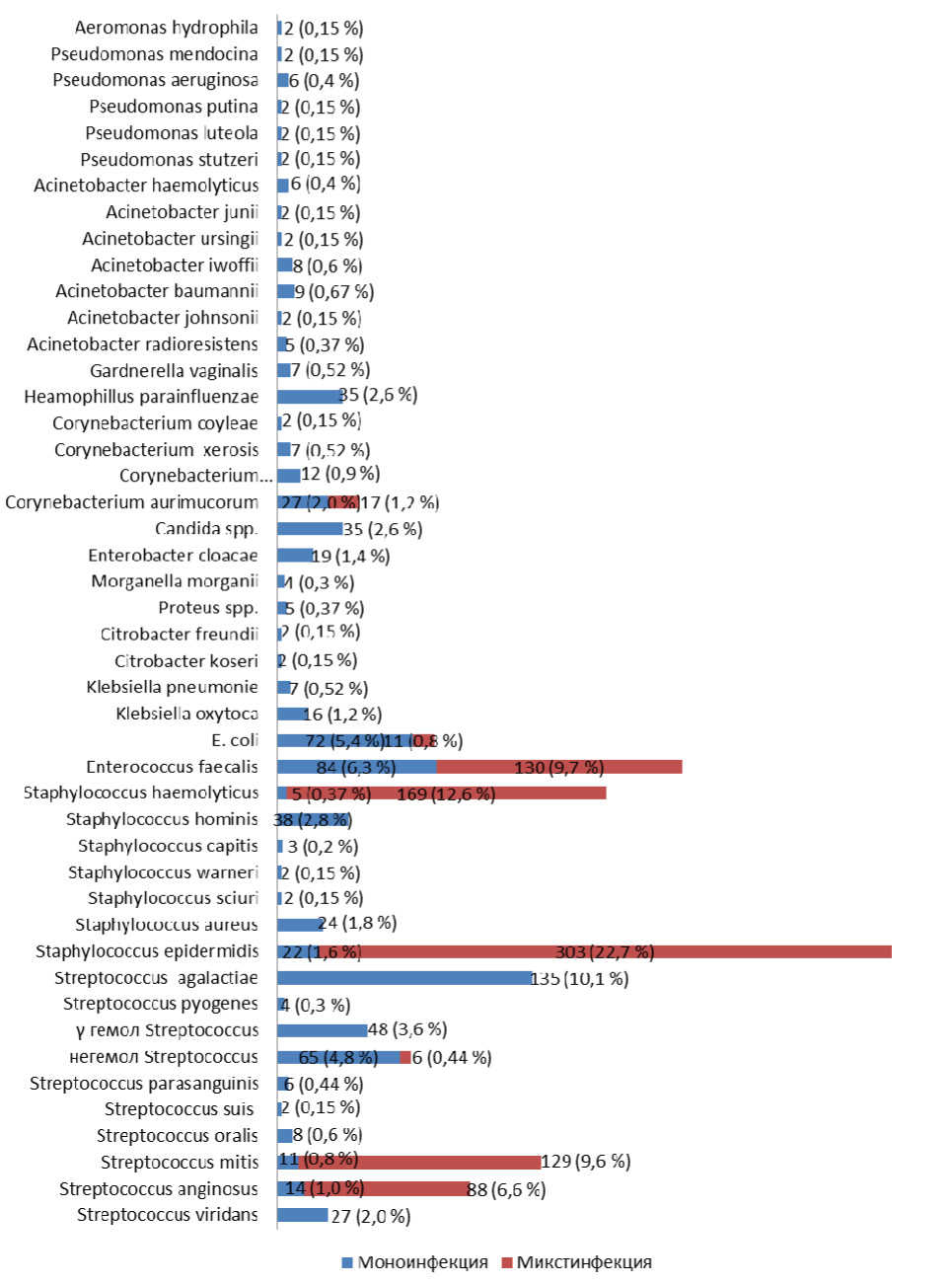
Рис. 1. Частота обнаружения условно-патогенных микроорганизмов у мужчин с негонококковыми уретритами (n=1335)*
*Поливариантный признак
Применение высокотехнологичного протеомного метода масс-спектрометрии позволило расширить представления о видовой структуре условно-патогенной микробиоты, в отличие от классических бактериологических методов, основанных на фенотипическом анализе: морфологических, тинкториальных, культуральных, биохимических и антигенных свойств микроорганизма.
Полученные данные свидетельствуют о том, что основную обсемененность урогенитального тракта составляют представители семейства Streptococcaceaе (56,6 %) – Enterococcus faecalis (16,0 %), Streptococcus mitis (10,4 %), Streptococcus agalactiae (10,1 %), Streptococcus anginosus (7,6 %), негемолитический Streptococcus (5,3 %), γ-гемолитический Streptococcus (3,6 %), Streptococcus viridans (2,0 %), Streptococcus oralis (0,6 %), Streptococcus parasanguinis (0,45 %), Streptococcus pyogenes (0,3 %), Streptococcus suis (0,2 %); семейства Micrococcaceae (42,4 %) – Staphylococcus epidermidis (24,3 %), Staphylococcus haemolyticus (13,0 %), Staphylococcus hominis (2,8 %), Staphylococcus aureus (1,8 %), Staphylococcus capitis (0,2 %), Staphylococcus warneri (0,15 %), Staphylococcus sciuri (0,15 %) и семейство Enterobacteriaceae (10,3 %) – Escherichia coli (6,2 %), Enterobacter cloacae (1,4 %), Klebsiella oxytoca (1,2 %), Klebsiella pneumonia (0,52 %), Proteus spp. (0,37 %), Morganella morganii (0,3 %), Citrobacter freundii (0,15 %), Citrobacter koseri (0,15 %). Небольшую группу представляют род Corynebacterium (5,7 %) – Corynebacterium aurimucorum (3,3 %), Corynebacterium glucuronolyticum (0,9 %), Corynebacterium xerosis (0,52 %), Corynebacterium coyleae (0,15 %), род Haemophilus – Haemophilus parainfluenzae (2,6 %), Gardnerella vaginalis (0,52 %), неферментирующие грамотрицательные палочки (3,6 %) – Acinetobacter baumannii (0,67 %), Acinetobacter lwoffii (0,6 %), Pseudomonas aeruginosa (0,45 %), Acinetobacter haemolyticus (0,45 %), Acinetobacter radioresistens (0,37 %), Pseudomonas mendocina (0,15 %), Pseudomonas putida (0,15 %), Pseudomonas luteola (0,15 %), Pseudomonas stutzeri (0,15 %), Acinetobacter junii (0,15 %), Acinetobacter ursingii (0,15 %), Acinetobacter johnsonii (0,15 %), дрожжеподобные грибы рода Candida albicans (2,6 %).
Как видно на рис. 1 наиболее часто высеваемые микроорганизмы, такие как Staphylococcus epidermidis (24,3 %), Staphylococcus haemolyticus (13,0 %), Streptococcus mitis (10,5 %), Streptococcus anginosus (7,6 %), чаще обнаруживались при микстинфекции в 22,7 %, 12,7 %, 9,7 %, 6,6 % случаев и только у 1,6 %, 0,3 %, 0,8 %, 1,0 % пациентов соответственно он выявлялись в виде моноинфекции.
Анализируя полученные данные бактериологического исследования отделяемого уретры у пациентов с НГУ отмечено, что Enterococcus faecalis выявлялся в 16,0 %, Streptococcus agalactiae в 10,1 %, Escherichia coli в 6,2 % случаев, являясь вероятной причиной воспаления в уретре.
E. faecalis обнаружен у 214 пациентов, что составило 16,0 % от общего числа больных с негонококковыми уретритами, у 84 (39,2 %) пациентов было выявлено моноинфицирование E. faecalis, а у 130 (60,8 %) больных E. faecalis диагностировался в ассоциации с другими микроорганизмами. Частота выявления микробных ассоциаций у больных с негонококковыми уретритами, ассоциированными с E. faecalis, представлена на рис. 2.
Из представленных на рис. 2 данных видно, что негонококковые уретриты, ассоциированные с E. faecalis чаще всего сочетались с Staphylococcus epidermidis в 43,8 % случаев, Staphylococcus haemolyticus в 19,2 % и Streptococcus anginosus в 16,1 % случаев.
Проведены исследования по определению чувствительности штамов E. faecalis, выделенных от 214 пациентов с негонококковыми уретритами к 15 антибактериальным препаратам различных групп (бензилпенициллин, ампициллин, гентамицин, стрептомицин, ципрофлоксацин, левофлоксацин, моксифлоксацин, эритромицин, клиндамицин, линезолид, хинупристин/дальфопристин, ванкомицин, тетрациклин, тайгециклин, нитрофурантоин). Как следует из данных представленных на рис. 3, штаммы E. faecalis показали формирование резистентности к бензилпенициллину (49,0 %) и ампициллину (52,0 %). Кроме того, обращает на себя внимание прогрессивное снижение чувствительности к гентамицину (57,0 %) и стрептомицину (64,5 %). Вместе с тем, отмечено, что все протестированные фторхинолоны обладали хорошей активностью в отношении E. faecalis. Так 59 (27,6 %) штаммов были не чувствительны к ципрофлоксацину, 45 (21,1 %) к левофлоксацину и 58 (27,2 %) к моксифлоксацину. Большинство штаммов E. faecalis (98,0 %) были чувствительны к нитрофурантоину и к ванкомицину (99,0 %). Препараты линезолид и тайгециклин демонстрировали 100 % активность к штаммам E. faecalis. Все штаммы E. faecalis были резистентны к эритромицину, клиндамицину, хинупристину/дальфопристину и тетрацик-
лину.
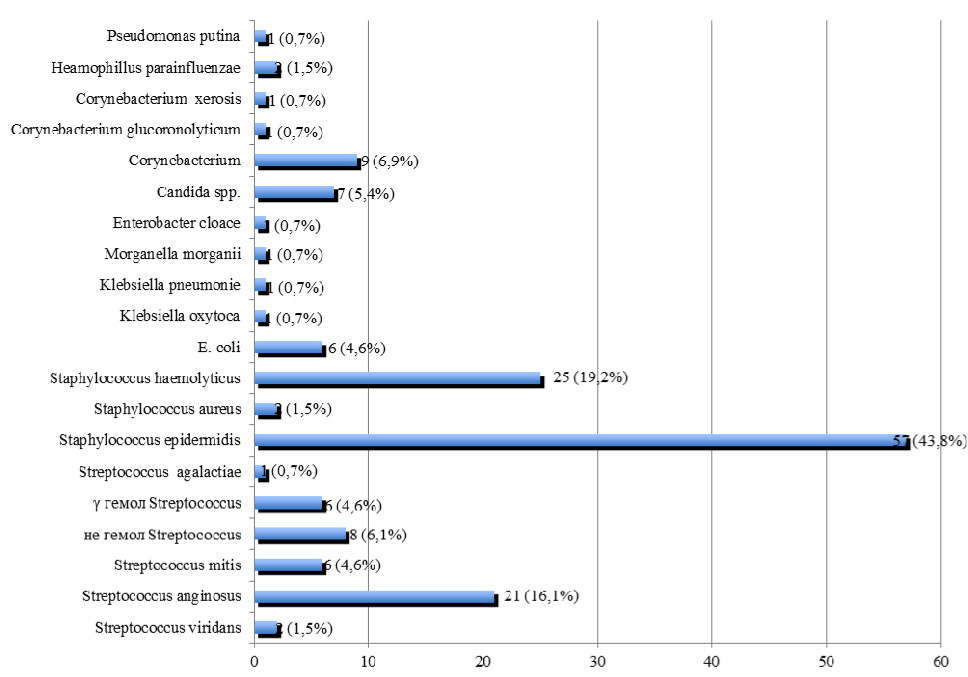
Рис. 2. Частота выявления микробных ассоциаций у больных с негонококковыми уретритами, ассоциированными с E. faecalis (n= 130)
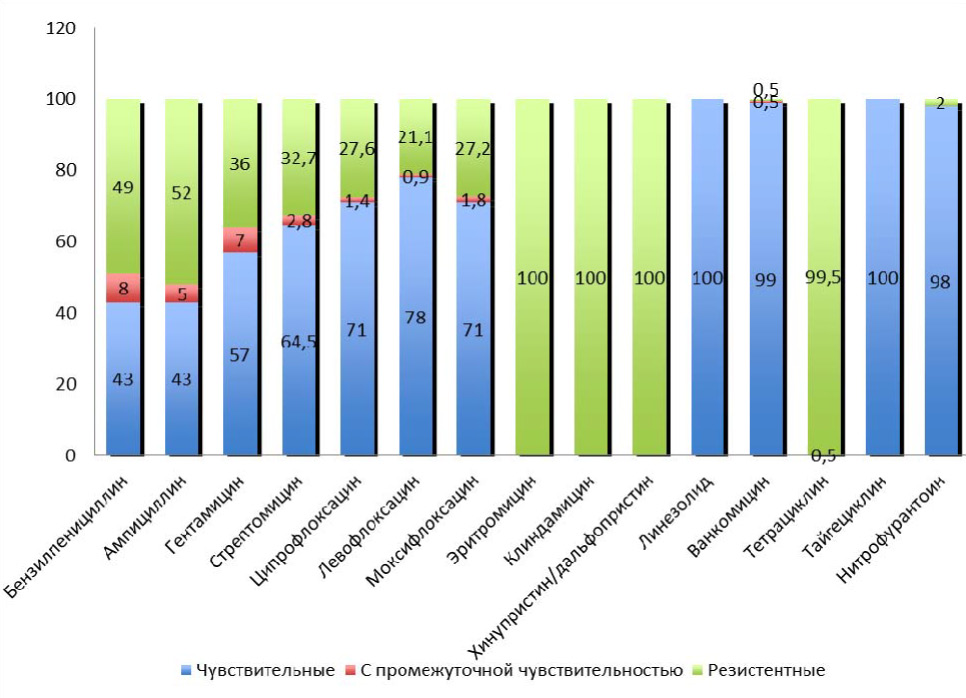
Рис. 3. Чувствительность (в %) к антибактериальным препаратам выделенных штамов Enterococcus faecalis (n = 214)
Обсуждение результатов. В настоящее время наиболее достоверным критерием, позволяющим охарактеризовать энтерококки в плане их потенциальной патогенности, является наличие у энтерококкового штамма набора генов патогенности. Обнаружена закономерная связь между наличием в штаммах энтерококков тех или иных генов патогенности и характером течения патологического процесса. Штаммы энтерококков в составе нормальной микрофлоры урогенитального тракта практически никогда не содержали генов цитолизинов при высоком содержании факторов адгезии [11]. Одним из наиболее изученных факторов E. faecalis является ген GelE, который кодирует гидролиз желатина, коллагена, казеина и других пептидов и контролируется FSR двухкомпонентной системой, состоящей из четырех генов (fsrA, fsrB, fsrD, and fsrC) (10, 14). Выработка двух вирулентных факторов: желатиназы (GelE) и сериновой протеазы (SprE) является кворум – зависимым процессом. Исследования последних лет показали, что желатиназа играет важную роль в формировании биопленок E. faecalis, что, возможно, обеспечивает их устойчивость к антибактериальной терапии (15).
Проведенное исследование показало высокую встречаемость E. faecalis (16,1 %) у больных с негонококковыми уретритами, в виде моноинфицирования у 84 (39,2 %) пациентов и в ассоциции с другими условно-патогенными микроорганизмами у 130 (60,8 %).
В настоящее время в клинической практике существуют два принципа назначения антибактериальных препаратов: эмпирическое и этиотропное. Эмпирическое назначение антибиотиков подразумевает применение антибактериальной терапии, основанной на знаниях о природной чувствительности бактерий, эпидемиологических данных о резистентности микроорганизмов в регионе, а также результатах контролируемых клинических исследований. Несомненным преимуществом эмпирического назначения антибактериальных препаратов является возможность быстрого начала терапии. Но данные литературы указывают на значительные трудности в выборе адекватной антибактериальной терапии при инфекциях, вызванных полирезистентными штаммами грамотрицательных бактерий, такими как Enterococcus spp.. Этиотропное назначение антибиотиков предполагает выделение возбудителя инфекции из клинического материала и определение его чувствительности к антибиотикам. Поэтому успешное лечение воспалительных заболеваний урогенитального тракта сопровождается микробиологическим исследованием. Возбудитель должен быть выявлен, идентифицирован и оценен на предмет его чувствительности к противомикробным средствам. Весьма проблемным в настоящее время является проведение антибактериальной терапии инфекционных процессов, ассоциированных с E. faecalis, характеризующимися множественной устойчивостью к антибиотикам. Причины развития антибиотикорезистентности до конца не установлены, однако не вызывает сомнения, что важную роль в этом играет необоснованное использование антимикробных препаратов, приводящая к селекции полирезистентных штаммов микроорганизмов как возбудителей, так и не являющихся этиологически значимыми, не входивших в спектр активности препарата, что наносит параллельный ущерб [6]. Формы устойчивости к антибиотикам становятся все более разнообразными, что требует применения новых технологий для их выявления. Оптимальным решением является автоматизация бактериологических исследований, позволяющая ускорять и стандартизировать процесс определения чувствительности.
Результаты определения чувствительности к бензилпенициллину и ампициллину – препаратам, наиболее часто применяемым для эмпирической терапии урогенитальных инфекций, показали резистентность штаммов E. faecalis в 49 %, 52 % случаев, соответственно. E. faecalis отличался значительной устойчивостью к важным для терапии энтерококковых инфекций препаратам – аминогликозидам. Умеренно-резистентные и резистентные штаммы E. faecalis выявлены к гентамицину в 43,0 %, к стрептомицину – в 35,5 % случаев. В ходе проведенного исследования установлено, что все 100 % штаммов E. faecalis были устойчивы к препаратам макролидам (эритромицин), линкозамидам (клиндамицин) и хинупристин/дальфопристину. Рядом исследований показано, что полирезистентность к макролидам, линкозамидам и стрептограминам определяется фенотипом MLSB, который обусловлен наличием генов еrm. Эти гены кодируют метилтрансферазу, которая метилирует рибосомы и предотвращает связывание антибиотика с мишенью.
Штаммы E. faecalis, выделенные от больных с НГУ проявляли чувствительность к антибактериальным препаратам линезолиду и тайгециклину (100 %), к ванкомицину (99,1 %), нитрофурантоину (98,1 %).
Возрастающая частота множественно-резистентных к традиционным антибактериальным препаратам штаммов E. faecalis, высокая чувствительность к фторхинолонам (78,0 % к левофлоксацину, 71,0 % к ципрофлоксацину и моксифлоксацину), появление новых препаратов этой группы с улучшенной активностью в отношении грамположительных микроорганизмов, позволяет рассматривать препараты группы фторхинолонов, которые не являются препаратами выбора, как альтернативные для терапии негонококковых уретритов обусловленных E. faecalis.
Таким образом, комплексное обследование отделяемого уретры 1335 пациентов с негонококковыми уретритами, с объективными и субъективными симптомами воспаления, с исключенными облигатными патогенами показало, что среди спектра условно-патогенных микроорганизмов E. faecalis выявлялся в 16,1 %, почти треть (39,2 %) из которых была в виде моноинфекции. Оценка чувствительности к антибактериальным препаратам выявила полирезистентность к традиционным препаратам и высокую чувствительность к фторхинолонам (78,0 % к левофлоксацину, 71,0 % к ципрофлоксацину и моксифлоксацину), что позволяет своевременно и дифференцированно подходить к назначению адекватной антибактериальной терапии.

