Одним из наиболее эффективных классов противоопухолевых цитостатиков являются производные платины. Их цитотоксический эффект обусловлен взаимодействием с молекулой ДНК. Успех применения в онкологии одного из первых полученных производных платины -цисплатина, химическое название цис-диамино-дихлор-платина (II), вызвал всплеск интереса к синтезу новых производных этого металла с предположительно противоопухолевой активностью. За 40 было синтезировано 3000 потенциально активных платиновых препаратов [3]. Некоторые из них приняты в практику лечения различных типов опухолей: карбоплатин, недаплатин и др. Возможность применения производных платиновых соединений ограничено значительными побочными эффектами, такими как нефротоксичность, появлением эффекта множественной лекарственной устойчивости и др. В настоящее время поиск новых препаратов на основе платины, по-видимому, исчерпал себя. Поэтому помимо платины изучается противоопухолевая активность комплексов других переходных металлов, в том числе палладия.
В связи с тем, что палладий является химическим «двойником» платины, но его соединения гораздо лабильнее и, как правило, менее токсичны по сравнению с соединениями последней, уже давно проводится направленный поиск биологически активных соединений палладия, и среди них обнаружены комплексы, проявляющие сравнимую или более высокую по сравнению с цис-платином биологическую активность. Среди перспективных классов как простейшие анионные комплексы типа морфозола (C5H12NO)2[PdCl4] [2], действующие по тому же механизму что и цисплатин, так и более сложные соединения, содержащие гетероароматические лиганды типа производных пиридина, 2,2-дипиридила и 1,10-фенантролина [4], а также фенантроцианиновые комплексы [1]. При поиске новых перспективных соединений особое внимание уделяется структурным аналогам цисплатина, прежде всего нейтральными диаминовым комлексам Pt(II) и Pd(II) цис-ML2X2, в том числе комплексам с хелатирующими лигандами такими как 2,2-дипиридилы, полипиридины и 1,10-фенантролины [7].
Действие таких соединений объясняется интеркаляцией, а не образованием внутримолекулярных сшивок в ДНК [5]. Из самых общих соображений следует, что возможны и другие механизмы нарушения репликации ДНК. Например, под действием активных металлоорганических соединений палладия возможна такая модификация цепочки ДНК, которая затрудняет или делает невозможной репликацию. К таким соединениям относятся, в частности, аллильные комплексы палладия, широко применяемые в тонком органическом синтезе. Они являются активными интермедиатами в ряде гомогенных каталитических реакций. Нам не удалось найти в литературе никаких сведений об исследованиях по противоопухолевой активности и цитотоксичности аллильных комплексов палладия, что довольно странно. Ведь известно, что при взаимодействии аллильных комплексов палладия с аминами и, очевидно, с азотистыми основаниями нуклеотидов образуются смешанные комплексы, где амин играет роль монодентатного лиганда, соединенного с центральным атомом связью Pd-N.
Особый интерес представляет такие соединения, которые способны нарушать репликацию ДНК, взаимодействуя с ней одновременно по нескольким механизмам. К ним, по нашему мнению, относятся катионные аллильные комплексы палладия [C3H5PdL]Cl с хелатными гетероароматическими лигандами L. Такого рода соединения легко образуются при взаимодействии аллильных комплексов [C3H5PdCl]2 c хелатирующими лигандами 2,2-дипиридилом и этилендиамином, но они, в отличие от исходных соединений, являются ионными и хорошо растворимы в воде. Примечательно, что влияние хлорид-иона, присутствующего в плазме крови, на растворимость комплекса невелико и не приводит к осаждению комплекса. Поскольку в растворах аллильных комплексов существует равновесие между формами с π- и σ-связанными лигандами С3Н5, в последнем случае наряду с интеркаляцией возможно и донорно-акцепторное взаимодействие координационно ненасыщенного атома палладия катиона с атомами азота нуклеотидов ДНК. Целью данной работы было сравнительное изучение противоопухолевого действия цисплатина и аллильных производных палладия с различными лигандами: фенантроллиновы и дипиридильным.
Материалы и методы исследования
В работе использовались аллильные производные палладия: аллил (4,7-диметил-1,10-фенантролин)палладий (II) хлорид (вещество I) и аллил (2,2-дипиридил)палладий(II) хлорид (вещество II), а также цисплатин. Соединения палладия были синтезированы в Институтете Неорганической химии им. Курнакова РАН.
Эксперименты по изучению противоопухолевой активности производных палладия и цис-платина проводились на мышах-самках линии СВА, которым перевивали опухоль шейки матки РШМ-5. Опухоль РШМ-5 была перевита всем группам мышей под кожу, стандартным методом. Мыши были разбиты на 4 группы: группа 1 получала вещество I, группа 2 – вещество II, группа 3-цисплатин (ЦП) и группа 4 – контроль. В контрольной группе было 19 мышей, а в экспериментальных – по 16. Введение препаратов начали при обнаружении у всех мышей первых пальпируемых узелков (через 10 дней после перевивки). Вещество I, вещество II или цисплатин вводили двукратно в дозе 2,5 мг/кг массы тела с интервалом 5 суток внутрибрюшинно (суммарная доза для всех трех препаратов 5 мг/кг). Вещество I и вещество II растворяли в дистиллированной воде. Контрольным мышам вводили двукратно дистиллированную воду. О противоопухолевом действии изучаемых веществ судили по результатам сопоставления среднего объема опухолей в контрольных и опытных группах. Объем вычислялся как произведение величин трех взаимно перпендикулярных размеров опухоли. Измерение опухолей проводилось 2 раза в неделю.
Результаты исследования и их обсуждение
На рисунке приведены данные по действию изучаемых веществ на рост перевиваемой опухоли шейки матки. Из рисунка видно, что все изучаемые вещества тормозят рост опухоли. Наиболее эффективным был цисплатин, который на начальных стадиях роста опухоли был более эффективен, чем производные палладия. На более поздних стадиях роста опухоли аллильное производное палладия II был по эффективности одинаков с цисплатином. Аллильное производное палладия I был менее эффективен на всех стадиях роста опухоли. В эксперименте происходила инволюция опухоли. В контроле таких случаев было 3, при действии вещества I – 8, вещества II – 7, а при действии цисплатина – 10. Поскольку инволюцию опухоли вызывали все изучаемые вещества, намного более эффективно, чем спонтанный процесс, то следует заключить, что эффект иновалюция опухоли обусловлен именно действием веществ, а не спонтанными событиями. Следует заметить, что в используемых нами дозах исследуемых веществ не наблюдалась гибель животных, что свидетельствует о возможности увеличения дозы и следовательно возможном усилении противоопухолевого эффекта.
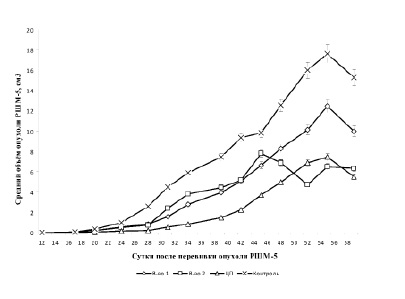
Влияние ЦП, вещества 1 и вещества 2 на рост перевиваемой опухоли ЗШМ-5
На основании полученных данных можно заключить, что противоопухолевое действие аллильных производных палладия на модели рака шейки матки сопоставимо с действием цисплатина. Поскольку соединение II было более эффективно, чем I, можно сделать вывод, что тип хелатной группы влияет на противоопухолевую активность аллильного производного палладия. Анализ литературы по противоопухолевому действию производных палладия произвести довольно сложно. Большинство исследователей использовали в качестве модели культуру опухолевых клеток, а опытов на животных ограниченное количество. На модели культуры клеток меланомы человека показано, что эффект изопропильных производных палладия также сильно зависит от структуры хелатной группы [6]. На модели опухолевых клеток желудка MKN28 и MKN45, устойчивых к действии цисплатина, глюкоконьюгированные комплексы палладия (II) вызывали гибель клеток [9]. На наш взгляд производные палладия являются соединениями способными увеличить противоопухолевый арсенал веществ, применяемых в клинике.

