Ретинопатия недоношенных (РН) – тяжелое вазопролиферативное заболевание, которое является одной из ведущих причин детской инвалидности по зрению [1,6]. Патогенез заболевания до конца не изучен и является предметом многочисленных исследований, немалая доля которых базируется на эксперименте [7,8].
В настоящее время наиболее популярными являются модели РН на крысах, что во многом основано на данных о высоком сходстве строения сосудистой системы глаз человека и крыс, а также сходстве процесса ретинальной васкуляризации [4,7,8]. Известно, что, при адекватном моделировании триггерную роль в развитии РН у животных играют колебания концентрации подаваемого в ходе эксперимента кислорода, которые, как было показано, приводят к дисбалансу про- и антиангиогенных факторов роста сосудов при развитии РН у детей [3].
Веки новорожденных крысят сращены до 14–15 суток. Данная особенность постнатального развития придаточного аппарата органа зрения делает невозможным проведение биомикроскопического и офтальмоскопического обследования глаз крысят в данный период времени, который, как известно, является критическим для развития РН, поэтому основную роль в оценке развития и течения заболевания играют морфологические и биохимические методы исследования.
Целью работы явилось изучение патоморфологических изменений при экспериментальной РН на разных сроках ее развития.
Материалы и методы исследования
Исследование выполнено на 64 новорожденных крысятах породы Вистар, которые были разделены на 2 равные по числу крысят группы: опытную, с экспериментальной РН, и контрольную. С целью воспроизведения экспериментальной РН новорожденных крысят на 14 суток помещали в инкубатор вместе с самкой. Каждые 12 часов концентрация кислорода в инкубаторе колебалась от 60 до 15 % (модель «60/15»). Выбранная схема подачи кислорода основывается на знании о том, что использование переменных концентраций кислорода является значительно более эффективным стимулом развития пролиферативной ретинопатии у новорожденных крысят в сравнении с воздействием постоянной гипероксии, и ряд исследователей полагают, что эпизоды гипоксии могут играть ключевую роль в патогенезе РН [7, 8]. Затем крысят помещали в условия с нормальным содержанием кислорода (21 %). На протяжении эксперимента в помещении поддерживали постоянный температурный (26°С) и световой (12 часов день, 12 часов ночь) режимы. Контрольную группу составили крысята, находившиеся с момента рождения в условиях с нормальным содержанием кислорода.
Крысят выводили из эксперимента на 10-е, 14-е, 18-е и 28-е сутки. Выбор сроков энуклеации основывался на сведениях о нормальном ангиогенезе сетчатки крысят, а также на результатах полученных ранее биохимических исследований [2]. Глаза (по 12 глаз из каждой группы на каждый срок) фиксировали в растворе Буэна 24 часа. На фиксированных глазах производили срединный разрез в области лимба и удаляли роговицу и хрусталик. После этого глаза подвергали стандартной гистологической проводке с последующей заливкой в парафин. Готовили серийные меридиональные срезы, которые окрашивали гематоксилином и эозином. Готовые препараты исследовали с помощью микроскопической системы фирмы Leica со встроенной цифровой камерой.
Энуклеированные на 14-е и 28-е сутки глаза (по 8 глаз из каждой группы) использовали для приготовления полутонких срезов и иммуногистохимического анализа. Для приготовления полутонких срезов глазные яблоки фиксировали в 10 % нейтральном формалине 2-е суток. После промывания и вскрытия глаз, выделенные фрагменты сетчатки дофиксировали в 4 % глутаральдегиде 1 сутки и в OsO4 1 час. Затем проводились обезвоживание в спиртах восходящей крепости и заливка в эпоксидную смолу. Срезы готовили на ультрамикротоме фирмы Leica (толщина срезов 1 микрон), помещали на предметные стекла и окрашивали метиленовым синим. Исследование осуществляли с помощью микроскопической системы фирмы Leica со встроенной цифровой камерой при увеличении х100 – х400. Для иммуногистохимического исследования использовали антитела к ядерному антигену пролиферирующих клеток PCNA (DAKO). Для этого в эпоксидных срезах проводилось удаление эпоксидной смолы (метод Compachiaro) с последующим иммунным окрашиванием путем использования стрептавидин-биотинового пероксидазного метода с использованием коммерческих наборов реагентов (DAKO).
Результаты исследования и их обсуждение
На 10-е сутки слои сетчатки глаз контрольной группы крысят характеризовались четкой дифференцировкой и были представлены: наружным и внутренним ядерным слоями (НЯС и ВЯС), наружным и внутренним плексиформным слоем (НПС и ВПС), слоем ганглиозных клеток (СГК). На крайней периферии НЯС и ВЯС сетчатки были разделены узким НПС, отмечалось наличие микрососудов в слое нервных волокон (СНВ), что является морфологическим маркером васкуляризации сетчатки (рис. 1 А). В глазах крысят из опытной группы на данном сроке наблюдалось нарушение стратификации слоев сетчатки на периферии: полностью отсутствовал НПС, а внутренний и наружный ядерные слои были представлены единым конгломератом без четкой дифференцировки. При этом, на крайней периферии сетчатки определялась аваскулярная зона (рис.1 Б), что позволяет сделать предположение о взаимосвязи обнаруженных структурных изменений сетчатки с нарушением васкуляризации ее периферических отделов.
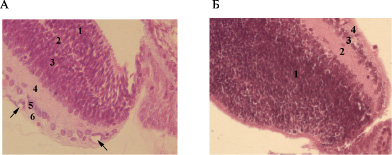
Рис. 1. Сетчатка новорожденных крыс на 10-е сутки рождения: А – В контроле: 1 – НЯС; 2 – НПС; 3 – ВЯС; 4 – ВПС; 5 – СГК; 6 – СНВ (стрелками указаны сосуды сетчатки); Б – В условиях кислородной инкубации в течение 10 суток: 1 – конгломерат ядер; 2 – ВПС; 3 – СГК; 4 – СНВ. Окраска гематоксилином и эозином. Увеличение х200
На 14-е сутки в контрольных глазах структура сетчатки и состояние ее сосудистой системы не имели значительных морфологических отличий по сравнению с аналогичным материалом на 10-е сутки (рис. 2 А). В опытных глазах на 14-е сутки, а именно, к моменту окончания воздействия на крысят переменных концентраций кислорода, отмечалось восстановление структуры сетчатки на периферии, которое сопровождалось врастанием сосудов и восстановлением кровообращения в этой зоне (рис. 2 Б). На полутонких срезах сетчатки крыс из опытной группы на данном сроке выявлялась гиперхромия ядер эндотелиальных клеток, наиболее выраженная в сосудах центральной зоны (рис. 2 В). Данные изменения указывали на повышенную функциональную активность эндотелия, не наблюдаемую в сосудах сетчатки крысят из контрольной группы (ядра эндотелиальных клеток крысят контрольной группы были гипохромны). Подтверждением этому служит обнаруженная нами экспрессия антигена PCNA в клетках эндотелия (рис. 2 Г), которая свидетельствовала об активизации их репликативного потенциала.
На 18-е и 28-е сутки в сетчатке крысят опытной группы отмечалось развитие патологической вазопролиферации. Определялось врастание сосудов до внутренней пограничной мембраны (ВПМ), в которой определялись деструктивные изменения. На 28-е сутки отмечался экстраретинальный рост сосудов в полость стекловидного тела через разрушенную ВПМ, что объективно указывало на прогрессирование патологического процесса (рис. 3. А, Б, В). При этом в эндотелии новообразованных сосудов определялась экспрессия антигенов к PCNA (рис. 3 Г). Полученные данные позволяют предполагать, что формируемые de novo сосуды могут принимают участие в формировании эпиретинальной мембраны, характерной для пролиферативной витреоретинопатии любой этиологии, и для РН в частности.
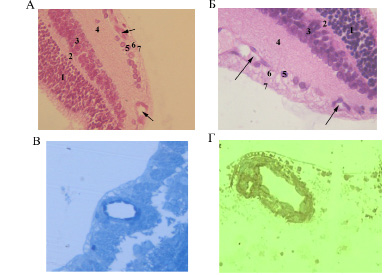
Рис. 2. Сетчатка новорожденных крыс на 14-е сутки после рождения: А – В контроле: 1 – НЯС; 2 – НПС; 3 – ВЯС; 4 – ВПС; 5 – СГК; 6 – СНВ; 7 – ВПМ (стрелками указаны сосуды сетчатки); Б – В условиях кислородной инкубации в течение 14 суток. Наблюдается появление сосудов на периферии сетчатки: 1 – НЯС; 2 – НПС; 3 – ВЯС; 4 – ВПС; 5 – СГК; 6 – СНВ; 7 – ВПМ (стрелками указаны сосуды сетчатки). Окраска гематоксилином и эозином. Увеличение х200. В) Гиперхромные ядра в эндотелии сосудов сетчатки у опытных животных. Полутонкие срезы. Окраска метиленовым синим. Увеличение х400; Г – Положительная экспрессия PCNA в ядрах эндотелиальных клеток ретинального сосуда у опытных крысят. Полутонкие срезы. Увеличение х400
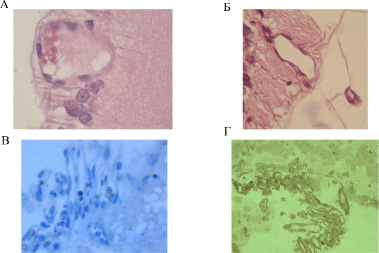
Рис. 3. Сетчатка новорожденных крысят на 18 и 28-е сутки после рождения: А – Сосуд сетчатки крысенка опытной группы на 18-е сутки, стенка которого располагается вплотную к ВПМ; Б – Сосуд сетчатки крысенка опытной группы на 28-е сутки. Разрушение ВПМ в зоне прорастания сосуда в стекловидное тело. Окраска гематоксилином и эозином. х400; В – Зона экстраретинального прорастания сосудов сетчатки в стекловидное тело у крысенка опытной группы на 28-е сутки. Полутонкий срез. Окраска метиленовым синим. х400; Г – Сохранение положительной экспрессии PCNA в ядрах эндотелиальных клеток ретинальных сосудов крысенка опытной группы на 28-е сутки. Полутонкий срез. х400
Полученные на нашей крысиной модели РН «60/15» результаты согласуются с данными литературы. Так, группой ученых на мышиной модели заболевания было показано, что при развитии ретинопатии на сроке, соответствующем пику неоваскуляризации, в препаратах сетчатки мышат определяются пролиферирующие ядра клеток, локализующихся с витреальной стороны от ВПМ сетчатки, в которых при иммуногистохимическом исследовании выявлялась повышенная экспрессия PCNA [9]. В ряде других исследований на крысиной модели РН «50/10» в препаратах сетчатки на 18-е сутки, которые также представляют собой пик неоваскуляризации в данной модели, определялись новообразованные сосуды на поверхности сетчатки в периферических отделах [5]. В нашей работе наряду с процессом патологической вазопролиферации сетчатки глаз крысят с экспериментальной РН, выявлены изменения структурной организации ядер эндотелиальных клеток ретинальных сосудов (появление гиперхромных ядер), коррелирующие с выраженной экспрессией PCNA. Это свидетельствует об изменении метаболизма эндотелиальных клеток в сторону активации их пролиферативного потенциала, что, в конечном итоге, определяет их избыточный патологический рост и прорастание через ВПМ сетчатки.
Заключение
Результаты проведенных патоморфологических и иммуногистохимических методов исследования доказывают стадийность изменений со стороны ретинальных сосудов в условиях экспериментальной РН. Наблюдающиеся в воспроизведенной нами оригинальной крысиной модели заболевания изменения аналогичны последовательным 1–3 стадиям активной фазы РН в клинике. Это свидетельствует об адекватности представленной экспериментальной модели и возможности ее использования для изучения различных аспектов патогенеза заболевания и поиска новых методов воздействия на ее развитие и течение.

