В настоящее время использование природных эфиров органических кислот с карбогидратами ограничено их малой доступностью, вследствие трудности изолирования из растений (минорные компоненты) и сложностью многостадийного синтеза (необходимость применения защитных групп), а также образования побочных продуктов при использовании хлорангидридов и ангидридов кислот.
В связи с вышеизложенным представляет интерес синтез и разработка простых и доступных способов получения сложных эфиров ароматических кислот с углеводами и многоатомными спиртами с целью увеличения водорастворимости, обеспечения активного транспорта веществ за счет спиртового фрагмента, усиления или даже изменения их физиологической активности.
Многие растения синтезируют физиологически активные фенолокислоты. Так например, салициловая кислота, которая обладает противовоспалительным, жаропонижающим, анальгезирующим, антибактериальным средством, в большом количестве находится в ветвях ивы (Salix) [1], галловая кислота, обладающая антибактериальным и противогрибковым действием, в небольших количествах присутствует в листьях чайного растения [2], герани и сумаха (Rhus typhina) [3], в чешуе лука содержание протокатеховой кислоты составляет до 2 %. Во многих растениях они так же обнаружены в виде сложных эфиров с полиолами: из Juncus effusus, которое широко применяется в Китайской народной медицине, были выделены и идентифицированы α- и β-изомеры n-кумароилглицерида [4], из растений ревеня (Rhubard) выделен 1–О-галлоилглицерин, в луковицах Lilium auratum идентифицированы 1–О-ферулоилглицерин, 1,2–О-диферулоилглицерин, 1–n-кумароил-2–О-ферулоилглицерин и ряд близких к ним производных оксикоричных кислот и глицерина [5]. В настоящей статье описан синтез α-моноглицеридов ароматических кислот, а также реакционная способность ароматических эфиров в реакции переэтерификации.
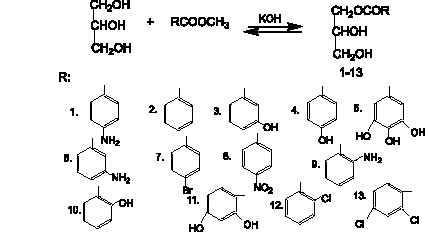
Реакция переэтерификации метиловых (этиловых) эфиров ароматических кислот глицерином в присутствии щелочного катализатора (КОН) является реакцией нуклеофильного замещения и протекает по механизму SN2 /1/. В отличие от алифатических кислот реакционная способность алкиловых эфиров ароматических кислот зависит от полярного влияния (электронных и пространственных эффектов) электронодонорных и электроноакцепторных заместителей, находящихся в n-, м- и о-положениях ароматического кольца на реакционный центр -СОО-.
В связи с этим выход α – моноглицеридов значительно различается (от 8–12 % для моноэфиров n – амино-, n – оксибензойной и галловой кислот, до 47–62 % для моноэфиров n – бромбензойной , n – нитробензойной, антраниловой и салициловой кислот.
Электроноакцепторные заместители (NO2, Br), находящиеся в n- и м- положении ароматического кольца, в основном за счет индукционного эффекта (+σJ) понижают электронную плотность на реакционном центре и тем самым способствуют протеканию реакции. Электронодонорные заместители (n-OH, n-NH2), в основном за счет резонансного эффекта (-R), увеличивают электронную плотность на реакционном центре и тем самым препятствуют протеканию реакции. При этом выход α-моноглицеридов коррелируют со значениями констант Гаммета (σn и σм) для донорных и акцепторных заместителей (табл. 1). Из табл. 1 видно, что при положительном значении констант Гаммета σn и σм выход α – моноглицеридов выше и при отрицательном значении наоборот ниже чем у α – моноглицерида незамещенной бензойной кислоты.
При реакции нуклеофильного замещения алкиловых эфиров орто-замещённых бензойных кислот, кроме электронных эффектов заместителей, на реакционный центр – СОО- оказывают влияние пространственные факторы. Окси- и амино- группы, находящиеся в о-положении к карбонилу, образуют внутримолекулярную водородную связь, которая вызывает увеличение положительного заряда на карбонильном углероде, отрицательного заряда на карбонильном кислороде и уменьшение отрицательного заряда на эфирном кислороде – О – СН3 (табл. 2), что способствует протеканию реакции. Согласно механизму реакции облегчается присоединение к реакционному центру глицерат иона и отщепление метоксильной группы с образованием метилата калия.
Таблица 1
Влияние электронных эффектов заместителей (n- и м-) на выход α – моноглицеридов
|
Заместит. в кольце |
Константа Гаммета |
Выход α-моноглицеридов, % |
||||
|
σn |
σм |
№ соед. |
n- |
№ соед. |
м- |
|
|
H |
0 |
0 |
2 |
31 |
- |
- |
|
OH |
-0,37 |
+0,12 |
4 |
9 |
3 |
33 |
|
NH2 |
-0,66 |
-0,16 |
1 |
8 |
6 |
25 |
|
Br |
0,23 |
+0,39 |
7 |
47 |
- |
- |
|
NO2 |
+0,78 |
+0,71 |
8 |
52 |
- |
- |
|
OH (м-,n-,м-) |
-0,37 |
+0,24 |
5 |
12 |
- |
- |
|
Σ= –0,13 |
||||||
При этом выход α – моноглицеридов салициловой кислоты (10) повышается на 31 %, а антраниловой кислоты (9) на 17 % по сравнению с α – моноглицеридами незамещенной бензойной кислоты и даже на 10 % выше чем для моноэфира n-нитробензойной кислоты (8), имеющего наибольшее положительное значение константы Гаммета для заместителя (таблица 2).
Реакционный центр метилового эфира 2,4–диоксибензойной кислоты испытывает антагонистическое влияние о – ОН, образующей внутримолекулярную водородную связь (ВВС) и способствующей протеканию реакции, и n – ОН группы, имеющей отрицательное значение константы Гаммета (σ = -0,37) и препятствующей протеканию реакции. При таком суммарном влиянии заместителей выход α-моноглицерида (11) составлял 26 %. При наличии в о-положении ароматического кольца галогена (Cl) на реакционный центр оказывают влияние электронный о-эффект, который характеризует костанта Тафта (σо = + 0,20) и пространственный фактор (ЕS = +0,18), в случае 2,4–дихлорбензойной кислоты еще и индукционный эффект n – Cl группы (σn= +0,23), которые уменьшают электронную плотность на реакционном центре и способствуют протеканию реакции. При таком суммарном влиянии электронных и пространственных эффектов выход α-моноглицеридов о-хлор- (12) и 2,4–дихлорбензойной (13) кислоты составляли 46 и 50 % соответственно. Проанализировав данные по влиянию электронных и пространственных факторов на реакционную способность о-, м- и n – замещенных бензойных кислот можно сделать вывод, что наибольшее влияние на усиление реакционной способности и увеличение выхода α – моноглицеридов оказывают о – ОН и о – NH2 заместители, образующие внутримолекулярную водородную связь и электроноакцепторные заметители о- и n- (NO2, Cl, Br), имеющие положительное значение электронных (σn, σo) и пространственных (ES) констант. При этом выход α-моноглицеридов по сравнению с незамещённой бензойной кислотой (31 %) значительно выше и составляет 42–62 %. Кроме того, исходя из литературных данных значений электронных и пространственных констант заместителей в ароматическом кольце [9] и наших экспериментальных данных по выходу α-моноглицеридов можно предсказать реакционную способность исходного алкилового эфира и выход α-моноглицеридов в реакции нуклеофильного замещения SN2 с глицерином по сравнению с незамещенной бензойной кислотой.
Таблица 2
Заряды на реакционном центре –СОО–– метиловых эфиров о-окси- и о-аминобензойной кислот и выход α-моноглицеридов
|
Заместители в кольце |
Электронные заряды, q* на -СОО- |
№ соед. |
Выход α-моноглицеридов, % |
||
|
qо С=О |
qс С=О |
q-о- |
|||
|
H |
–0,6031 |
+0,8171 |
–0,4809 |
2 |
31 |
|
O – OH |
–0,6316 |
+0,8459 |
–0,4770 |
10 |
62 |
|
O – NH2 |
–0,6085 |
+0,8245 |
–0,4764 |
9 |
48 |
* Квантовохимический расчет электронных зарядов осуществлен методом MINDO-3.
α-Моноглицериды ароматических кислот (1–13) выделяли из реакционной смеси колоночной хроматографией. Структура моноэфиров (1–13) подтверждена данными элементного анализа, ИК-, ПМР- и ЯМР 13С- спектрами.
В ИК-спектрах α-моноглицеридов (1–13) валентные колебания С=С связей ароматического кольца находятся в области 1450–1620 см-1, колебания С=О сложноэфирной группы – 1660–1760 см-1, присутствуют также колебания ассоциированных ОН-групп в области 3100–3600 см-1.
В спектрах ПМР синтезированных соединений (1–13), помимо сигналов ароматических протонов при 6,4–8,08 м.д., присутствуют сигналы протонов остатка глицерина: двухпротонный дублет в области 4,6–4,72 м.д., соответствующий метиленовым протонам ацилированной первичной спиртовой группы, и двухпротонный дублет в области 3,9–4,1 м.д., обусловленный метиленовыми протонами, находящимися в геминальном положении к гидроксилу. Метиновый протон вторичной гидроксильной группы глицерина представлен мультиплетом при 4,10–4,55 м.д.
Спектры ЯМР 13С α – моноглицеридов (1–13) также подтверждают, что ацилируется первичная гидроксильная группа глицерина, так как атомы углерода (С-1), находящиеся в a-положении к сложноэфирной группе, претерпевают слабопольное смещение на 2,5 – 4,5 м.д., а в положении С – 2 – сильнопольное смещение на 2 – 3 м.д. по сравнению со значениями химических сдвигов атомов углерода незамещенного глицерина. Химический сдвиг атома углерода С – 3, находящегося в a – положении по отношению к другой первичной гидроксильной группе глицерина, изменяется незначительно (Δd = ±0,2 м.д.). Химические сдвиги атомов углерода ароматической части a-моноглицеридов находятся в согласии со сдвигами исходных метиловых эфиров.
Физико-химические характеристики a-моноглицеридов ароматических кислот (1–13), полученные реакцией переэтерификации, приведены в табл. 3, спектральные данные в табл. 4,5.
Таблица 3
Физико-химические характеристики a-моноглицеридов ароматических кислот (1–13)
|
№ |
Выход, % |
Т. пл. °С, nD20, d420 |
Rf |
|
1 |
56 |
1,5238; 1,2855 |
0,56 |
|
2 |
31 |
1,5360; 1,6181 |
0,43 |
|
3 |
33 |
90 – 91 |
0,15 |
|
4 |
9 |
155 – 157 |
0,32 |
|
5 |
12 |
178 – 180 |
0,16 |
|
6 |
25 |
141 – 142,5 |
0,32 |
|
7 |
47 |
72–74 |
0,45 |
|
8 |
52 |
105 – 107 |
0,40 |
|
9 |
48 |
87 – 88 |
0,40 |
|
10 |
72 |
69–70 |
0,38 |
|
11 |
26 |
150 -152 |
0,35 |
|
12 |
46 |
1,5370 ; 1,7335 |
0,40 |
|
13 |
50 |
68 – 70 |
0,40 |
Таблица 4
Спектральные характеристики a-моноглицеридов ароматических кислот (1–13)
|
№ |
ИК-спектр, ν, см-1 |
ЯМР 13С – спектр, δ (Δδ), м.д. |
|||
|
С = O |
C = C, NH2, C-Cl, C-Br, Ar-NO2 |
Глицериновая часть |
|||
|
С – 3 |
С – 2 |
С – 1 |
|||
|
1 |
1460; 1520; 1605 |
1690 |
65,52 (+2,68) |
70,24 (-1,96) |
63,02 (+0,18) |
|
2 |
1715 |
C=C: 1600, 1585, 1500 |
66,0 (+3,16) |
70,0 (-2,2) |
63,0 (+0,16) |
|
3 |
1720 |
C=C: 1590б 1460 |
65,6 (+2,76) |
69,80 (-2,4) |
62,8 (-0,04) |
|
4 |
1690 |
C=C: 1610, 1500, 1460 |
65,8 (+2,96) |
69,9 (-2,3) |
62,9 (+0,06) |
|
5 |
1700 |
C=C: 1535, 1455 |
65,4 (+2,56) |
70,0 (-2,2) |
62,8 (-0,04) |
|
6 |
1720 |
C=C: 1600, 1490 |
65,7 (+2,86) |
69,9 (-2,3) |
63,0 (+0,16) |
|
7 |
1715 |
C=C: 1590, 1485 C – Br: 690 |
66,2 (+3,36) |
69,9 (-2,3) |
63,0 (+0,16) |
|
8 |
1725 |
C=C: 1605, 1445 Ar-NO2: 1355, 1520 |
67,2 (+4,36) |
69,8 (-2,4) |
63,0 (+0,16) |
|
9 |
1690 |
C=C: 1620, 1595, 1560; NH2: 3360, 3470 |
65,4 (+2,56) |
70,0 (-2,2) |
70,0 (-2,2) |
|
10 |
1500; 1585; 1600 |
1680 |
65,99 (+3,15) |
69,82 (-2,38) |
62,80 (-0,04) |
|
11 |
1660 |
C=C: 1620, 1520, 1500, 1460 |
65,4 (+2,56) |
69,8 (-2,4) |
62,8 (-0,04) |
|
12 |
1720 |
C=C: 1596, 1480 C – Cl: 680, 740 |
66,4 (+3,56) |
69,8 (-2,4) |
63,0 (+0,16) |
|
13 |
1715 |
C=C: 1480, 1590 C – Cl: 760, 640 |
66,5 (+3,66) |
69,8 (-2,4) |
63,0 (+0,16) |
Таблица 5
ПМР – спектры a-моноглицеридов ароматических кислот (1–13), δ (м.д.), J (Гц)
|
№ |
СН2– ОСО |
СН – ОН |
СН2–ОН |
Ar, –CH=, o–CH3, –OH |
|
1 |
4,27(2H, д, J = 4Гц) |
3,90–3,97 (1H, м) |
3,64 (2Н, д, J = 4 Гц) |
7,79 (2H, д, Ar); 4,90 (4H, 2OH,NH2) |
|
2 |
4,64 (2H, д, J = 4Гц) |
4,13–4,49 (1H, м) |
4,0 (2Н, д, J = 4 Гц) |
7,20 (5H, Ar); 6,1 (2H, c, OH) |
|
3 |
4,65 (2H, д, J = 4Гц) |
4,10–4,48 (1H, м) |
3,95 (2Н, д, J = 4 Гц) |
7,01 (4H, Ar); 5,5 (2H, c, OH) |
|
4 |
4,6 (2H, д, J = 4Гц) |
4,10–4,41 (1H, м) |
3,91 (2Н, д, J =4 Гц) |
6,90 – 7,95 (4H, Ar ) |
|
5 |
4,61 (2H, д, J = 4Гц) |
4,0 – 4,54 (1H, м) |
3,92 (2Н, д, J =4 Гц) |
7,5 (2H, c) |
|
6 |
4,72 (2H, д, J = 5Гц) |
4,13–4,53 (1H, м) |
4,0 (2Н, д, J = 5 Гц) |
7,02 – 7,65 (4H, м, Ar); 5,69 (4H, c, 2OH, NH2) |
|
7 |
4,65 (2H, д, J = 4Гц) |
4,10–4,49 (1H, м) |
3,98 (2Н, д, J = 4 Гц) |
7,35 – 7,80 (4H, Ar); 5,75 (2H, c, OH) |
|
8 |
4,72 (2H, д, J = 4Гц) |
4,18–4,55 (1H, м) |
4,02 (2Н, д, J = 4Гц) |
8,08 (4H, c, Ar); 5,7 (2H,c, OH) |
|
9 |
4,7 (2H, д, J = 5Гц) |
4,28 – 4,5 (1H, м) |
4,04 (2Н, д, J = 5 Гц) |
6,5 – 7,96 (4H, Ar); 5,8 (4H, c, 2OH, NH2) |
|
10 |
4,25 (2Н, д, J = 4 Гц) |
3,89 – 3,96 (1Н, м) |
3,60 (2Н, д, J = 4 Гц, СН2ОН); |
4,89 (3Н, ОН); 6,75 – 7,85 (4Н, С6Н4) |
|
11 |
4,60 (2H, д, J = 4Гц) |
4,10–4,41 (1H, м) |
3,98 (2Н, д, J =4 Гц) |
6,41 – 7,7 (4H, Ar) |
|
12 |
4,69 (2H, д, J = 4Гц) |
4,13–4,5 (1H, м) |
4,0 (2Н, д, J = 5 Гц) |
7,0–7,74 (4H, Ar) |
|
13 |
4,69 (2H, д, J = 5Гц) |
4,13–4,45 (1H, м) |
4,0 (2Н, д, J = 5 Гц) |
7,11 – 7,71 (3H, Ar); 5,8 (2H, c, OH) |
Экспериментальная часть. ИК-спектры синтезированных соединений сняты на приборе «Bruker Alfa». ПМР-спектры соединений записаны на спектрометре «Tesla BS – 487 C» с рабочей частотой 80 МГц и на спектрометре «Mercury – 300» с рабочей частотой 300 МГц при комнатной температуре, внутренний стандарт ГМДС. Спектры ЯМР 13С сняты на спектрометре «Bruker WP-80» и «Mercury – 300» с рабочей частотой 20,15 МГц и 75 МГц соответственно (в CD3OD, C5D5N, DMCO-d6; O-TMC). Температура плавления определена на приборе «Boetius». Индивидуальность соединений подтверждена методом ТСХ на пластинках «Silufol» в различных системах растворителей, данными элементного анализа и спектрами (ИК-, ПМР и ЯМР 13С).
Синтез α-моноглицеридов (1–13) реакцией переэтерификации. 0,1 моля метилового эфира соответствующей кислоты нагревали с 27,6 г (0,3 моль) глицерина в присутствии 0,084 г (0,003 моль) КОН при температуре 180–200оС в течение 4–12 часов в атмосфере инертного газа – азота. После окончания реакции продукт извлекали этилацетатом, отмывали от избытка глицерина насыщенным раствором NaCl, высушивали над MgSO4 и отогнали растворитель. α-Моноглицериды (1–13) из реакционной смеси выделяли колоночной хроматографией на силикагеле L(0,04–0,1 мм), элюируя хлороформом и смесью растворителей хлороформ-метанол в соотношении 9:1 и 4:1.

