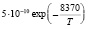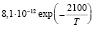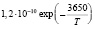Актуальность исследований предотвращения горения и взрыва газов определяется как новыми проблемами теории этих процессов, так и широким использованием их в технике и соответствующим увеличением количества случаев разного рода техногенных катастроф. Особый интерес к проблемам ингибирования газофазных процессов возник после того, как выяснилось, что наука о горении газов вплоть до настоящего времени сохраняет некоторую неопределенность в подходах. «Дуализм» встречается в работах Н.Н. Семенова, из которых исторически сложилась и развилась макрокинетика. В конце 1920-х – начале 1930-х гг. Н.Н. Семенов опубликовал несколько статей с несколько противоположным содержанием: цепная теория цепей, основанная на отслеживании размножения и уменьшении промежуточных продуктов активных радикалов. Другая серия работ привела к развитию так называемой «тепловой теории» горения Зельдовича и Франка-Каменецкого [1]. Слово «тепловая» подчеркивает, что основной механизм поддержания ускоряющих физико-химических процессов обусловлен температурной зависимостью Аррениуса. Кстати, в этом году исполняется 130 лет с того времени, как Сванте Аррениус опубликовал уравнение, сыгравшее важную роль в истории науки XX века. Уравнение (далее УА) имеет вид
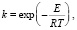 (1)
(1)
где А – предэкспонент, Е – энергия активации, а R и T, как обычно – газовая постоянная и температура. Интересно, что Аррениус не предлагал для его обоснования никаких теоретических гипотез или объяснений, а просто выбрал его из нескольких вариантов, предлагаемых для описания сугубо химико-технологического процесса очистки тростникового сахара. Эта очень простая по форме записи и сути формула оказалась удивительно интересной и плодотворной. Использование уравнения Аррениуса контрастирует с «цепным» механизмом, основанным на рассмотрении элементарных реакций, ответственных за горение газов. Дело в том, что реакции между валентно-насыщенными молекулами имеют энергии активации значительно больше (на десятки кДж / моль и более) по сравнению с реакциями с участием свободных атомов и радикалов. В реальных системах механизм взаимодействия определяется быстрыми реакциями цепных носителей и тем, насколько быстро они размножаются и гибнут. Однако желание упростить анализ систем уравнений для физических и химических процессов горения, иногда используя аналитические методы (включая упрощенные методы интегрирования экспонент), привело к тому, что стали использоваться выражения для аррениусовской скорости химической реакции для реакций нулевого или первого порядка. Часто они дают бессмысленные энергии активации и предэкспоненциальные факторы, выбранные только для удовлетворения экспериментальных данных, но не дают реального описания процессов горения [2]. Этот подход получил широкое распространение под названием «глобальный кинетический механизм». Например, в [3] для горения метана с кислородом используется эмпирическая одностадийная кинетическая схема. Кинетические параметры выбраны из экспериментально измеренной скорости пламени, что позволило провести расчеты двух- и трехмерных потоков, в том числе турбулентных. Следует также отметить, что даже академик Н.Н. Семенов отверг правильную концепцию для цепного механизма реакции водорода и кислорода на третьем пределе воспламенения. Согласно «новой» версии, представленной в монографии Семенова [4], он принял, что расчеты Франка-Каменецкого константы Аррениуса, взятые из эксперимента, также хорошо описывают реакцию при высоких давлениях. Фактически данные Франка-Каменецкого были получены обработкой экспериментальных результатов при помощи аррениусовской анаморфозы. Этот пример демонстрирует один из, как правило, безуспешных подходов к моделированию физико-химических процессов. Если анализ экспериментальных данных осуществляется исключительно с использованием гипотезы Аррениуса, то получается порочный круг [5]. Все это привело к тому, что изучение различных аспектов ингибирования горения газовых смесей, в частности эффекта синергизма одновременного действия нескольких присадок. Обычно эффектом синергизма ингибиторов называется экспериментально установленное смещение пределов воспламенения газовых смесей на величину большую, чем смещение пределов, от суммирования действия каждой присадки отдельно. При этом кроме общих слов о цепном процессе не приводится конкретных объяснений, почему и данный эффект возникает [6].
Согласно методике, описанной в работе [7], где изучался эффект ингибирования воспламенения стехиометрической смеси водорода и кислорода на первом пределе при помощи присадок этанола, изучить действие присадок другого ингибитора (пропана) и смесей этих ингибиторов (этанола и пропана). Экспериментальные результаты сравниваются с расчетными, делаются выводы.
Материалы и методы исследования
Определялись первые пределы самовоспламенения горючей смеси с малыми присадками веществ, реакция которых с носителем цепей подлежат изучению. Эксперимент проводился на установке, схематически представленной на рис. 1 [7]. Электрическая печь 1 с терморегулятором 7, обеспечивала постоянство заданной температуры. Давление контролировалось при помощи мембранного датчика МС2000 с точностью до 10 н/м2. Температура измерялась термопарой 8. В нагретый реактор 2 из перепускного объема 6 быстрым поворотом крана впускали заданную порцию исследуемой смеси. Воспламенение регистрировалось по вспышке хемилюминесценции, визуально через кварцевое окно 9.
Результаты исследования и их обсуждение
На рис. 2 представлены измеренные первые пределы смеси 2Н2 + O2 с различными присадками пропана и сложных ингибиторов (смесей этанола и пропана), а также первые пределы при ингибировании этанолом [7].
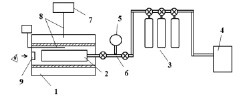
Рис. 1. Схема экспериментальной установки: 1 – электрическая печь, 2 – кварцевый реактор, 3 – баллоны с газовой смесью, 4 – форвакуумный насос, 5 – датчик давления, 6 – перепускной объем, 7 – терморегулятор, 8 – термопары, 9 – кварцевое окно для фиксации вспышки [7]
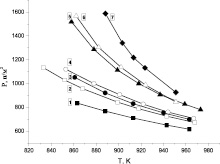
Рис. 2. Экспериментально измеренные первые пределы воспламенения стехиометрической смеси водорода с кислородом с различными добавками 1 – без добавок [7], 2 – 0,66 % этанола [7], 3 – 1 % этанола [7], 4 – 0,1 % пропана, 5 – 0,2 % пропана, 6 – смесь 0,1 % пропана и 0,66 % этанола, 7 – смесь 0,1 % пропана и 1 % этанола
Известно [2], что первый предел воспламенения гремучей смеси достигается при равенстве скорости размножения атомов Н, равной 2k2[О2][Н] и скорости гетерогенной гибели этих атомов на стенках реактора k4[Н]. Концентрация [О2] рассчитывается по температуре и давлению смеси. Диффузия в диффузионной области определяется константой k4, которая для цилиндрического реактора диаметром d равна
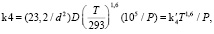 (2)
(2)
где D – коэффициент диффузии атомов H при Т = 293 К и P = 100 кПа, – 2,4х10-4 м2/с.
В присутствии ингибитора уравнение предела запишется в следующем виде:
2 k2[О2] = k4 + king[Ing]. (3)
Эксперименты с одиночными ингибиторами позволяют рассчитать методами, изложенными в [7] входящие в уравнения константы k2, и king (таблица).
Для смеси ингибиторов уравнение (2) записывается следующим образом:
2 k2[О2] = k4 + king1[Ing1] + king2 [Ing2]. (4)
Рассчитанные из экспериментов значения кинетических констант
|
Реакция |
Н + О2 = ОН + О |
H + С2Н5OH |
H + С3 Н8 |
|
k2 [6] |
kingC2H5OH [6] |
kingC3H8 |
|
|
k, см3/(мол∙с) |
|
|
|
Так как все входящие в уравнение (4) константы измерены в экспериментах с одиночными ингибиторами (таблица), то можно рассчитать теоретические кривые P(T), сделать вывод о правильности представлений о независимом действии ингибиторов, рассчитать синергетический эффект, а также сравнить, насколько отличаются экспериментальные результаты действия сложного ингибитора и оценок путем механического сложения ординат смещения пределов при одиночных присадках (этанол и пропан). Эти результаты представлены на рис. 3.
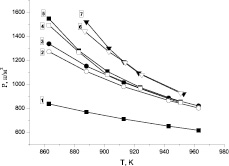
Рис. 3. Сравнение результатов экспериментов по ингибированию сложными присадками: 5 – смесь 0,1 % пропана и 0,66 % этанола и 7 – смесь 0,1 % пропана и 1 % этанола с расчетами по формуле (3): 4, 6 соответственно и оценок действия этих смесей, полученных сложением ординат смещения пределов из-за ингибирования одиночными присадками (кривые 2, 3, 4 – рис. 2): 2, 3 соответственно 1 – H2 без добавок [7]
Заключение
Хорошее совпадение результатов экспериментов по ингибированию сложными присадками с расчетами по формуле (4) с использованием констант, полученных из экспериментов с одиночными присадками (таблица) говорит о правильности представлений о механизмах ингибирования смесей водорода с кислородом [6]. Наглядно показано, как возникает так называемый синергетический эффект совместного действия ингибиторов, заключающийся в превышении эффекта действия сложной присадки по сравнению с механической суммой действия одиночных присадок. При этом ингибиторы действуют независимо друг от друга, и между ними нет химического взаимодействия. Практический вывод из данной работы заключается в перспективности использования сложных ингибиторов, состоящих из смеси нескольких веществ. Представляется интересной возможность использования конденсированных веществ, пары которых могут быть дополнены газообразными ингибиторами для получения необходимого эффекта ингибирования. Поиски подобных комбинаций являются интересным направлением дальнейших исследований.