Подавляющее большинство рутинных биохимических методов основано на использовании фотометров – приборов, измеряющих оптическую плотность анализируемого раствора при определенной длине волны светового излучения [1, 2]. Современные фотометры подразделяются по положению луча проходящего света относительно поверхности изучаемого раствора на горизонтальные (кюветные) и вертикальные (планшетные).
В классической горизонтальной фотометрии изучаемый раствор наливают в кювету прямоугольной или цилиндрической формы, а луч света от источника излучения проходит через кювету сбоку, параллельно поверхности жидкости (рис. 1, А). Длина оптического пути при этом определяется толщиной кюветы, которая, как правило, имеет боковые стенки шириной ровно 1 см. Для проведения измерений данным способом требуется достаточно большой объем изучаемого раствора: 2,5–3 мл при использовании обычных прямоугольных кювет и 1 мл при использовании микрокювет с дополнительными внутренними стенками. Кроме того, пробы можно помещать в аналитическую кювету только по очереди, а между пробами кювету необходимо ополаскивать, что не дает полной гарантии удаления следов предыдущего раствора.
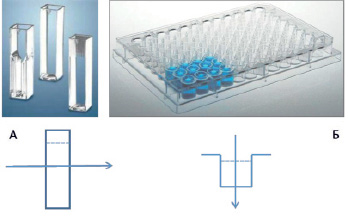
Рис. 1. Направление луча света от источника излучения в горизонтальной (А) и вертикальной (Б) фотометрии. Пунктиром показана поверхность жидкости
Метод вертикальной планшетной фотометрии был разработан в 1960-х гг. Как показано на рис. 1, Б, изучаемый раствор наливают в лунки планшета, а луч света проходит через раствор сверху, перпендикулярно поверхности жидкости. Если рассматривать планшет как соединенные в одну конструкцию микрокюветы, то у них окажется только одна грань на пути луча света – нижняя, а функцию верхней грани выполняет мениск жидкости. Соответственно, длина оптического пути будет зависеть от объема помещенного в ячейку раствора. Основным преимуществом планшетных фотометров является возможность экономно расходовать биоматериал и реагенты. Для самых распространенных 96-луночных планшетов объем ячейки рассчитан на использование всего 0,1–0,3 мл инкубационной среды – на порядок ниже, чем при горизонтальной фотометрии. Кроме того, оптическая плотность растворов в ячейках планшета считывается автоматически, в один прием, что значительно сокращает время анализа.
Как правило, адаптацией биохимических методов к условиям планшетной фотометрии занимаются фирмы, производящие планшетные фотометры или клинические биохимические тест-наборы. Целью данной статьи является разработка общего алгоритма, который позволит исследователям, работающим в области прикладной биохимии, самостоятельно адаптировать к условиям планшетной фотометрии любые спектрофотометрические биохимические методы, встречающиеся в научной литературе, делая при этом поправки на тип и разновидность имеющегося планшетного фотометра.
Типы планшетных фотометров
Современные планшетные фотометры имеют очень большой ценовой разброс, в зависимости от устройства основных блоков. К основным блокам, определяющим тип и стоимость планшетного фотометра, относятся:
1) блок выделения отдельных длин волн светового излучения (монохроматор в более дорогих моделях, система светофильтров – в более дешевых);
2) блок инжекции компонентов реакции (в более дорогих моделях компоненты реакции вносятся в ячейки планшета автоматическим пробоотборником и инкубируются внутри прибора, в более дешевых моделях заполнение планшетов реагентами производится вручную, а инкубация смеси – во внешнем термошейкере). Первый тип фотометра носит название «автоматического», а второй – «полуавтоматического».
Как будет показано ниже, эти две характеристики планшетного фотометра и определяют основные различия процедуры адаптации биохимических методов, но в любом случае эта процедура направлена на то, чтобы вывести конечную формулу пересчета величин оптической плотности в концентрацию изучаемого вещества, используя закон Бугера – Ламберта – Бера.
Согласно этому закону, оптическая плотность раствора в максимуме поглощения данного вещества (D) пропорциональна его молярной концентрации (С), длине оптического пути (L) и молярному коэффициенту экстинкции (Em):
D = C*Em*L.
Молярный коэффициент экстинкции показывает, какой оптической плотностью обладал бы раствор данного вещества с концентрацией 1 M (1 моль/литр) в кювете толщиной 1 см при данной длине волны падающего света. Для многих аналитически важных молекул – метаболитов или их комплексов с красителями – величины Em табулированы и содержатся в справочниках – например, в «Справочнике биохимика» Досона [3]. Кроме того, их можно найти в статьях химиков и биохимиков, а также – при наличии стандарта определяемого вещества – измерить самостоятельно.
Пошаговый алгоритм адаптации биохимических методов к условиям вертикальной планшетной фотометрии
Этап 1. В методических руководствах и статьях, как правило, приводится длина волны максимума поглощения продукта реакции и величина соответствующего молярного коэффициента экстинкции, которые достаточны для налаживания метода на спектрофотометрах с монохроматорами, дающими непрерывный спектр падающего света. Замена монохроматора в бюджетных моделях фотометров на систему светофильтров (как правило, 7–8 фильтров для видимой области спектра начиная с длины волны 340 нм, в некоторых моделях до 14 светофильтров) делает первым шагом адаптации данного метода к условиям планшетной фотометрии выбор подходящего светофильтра из набора имеющихся в приборе.
Для выбора светофильтра необходимо прежде всего найти по литературным данным непрерывные спектры поглощения аналита и остальных компонентов данной реакции. Удачными ключевыми словами для поиска в Google Scholar является химическое название аналита или другого компонента изучаемой реакции на английском языке в сочетании со словами «absorption», «spectrum» или «visible/UV».
Следует учесть, что выбор светофильтра не является формальной процедурой и требует анализа найденных спектров поглощения компонентов реакции. Например, спектр поглощения окрашенного хинонимина в методе определения содержания в сыворотке мочевой кислоты с максимумом при 520 нм (кривая 1 на рис. 2) имеет более пологую левую ветвь, из-за чего из двух рассматриваемых светофильтров с максимумами пропускания 492 и 540 нм следует выбрать не более близкий по длине волны (540 нм), а дающий меньшие потери экстинкции по сравнению с максимумом поглощения аналита (492 нм). Однако, как показано в работе [4], используемые в этом методе реагенты образуют цветной комплекс и с билирубином (кривая 2 на рис. 2), спектр которого имеет максимум при 430 нм, но интерферирует со спектром основного продукта вплоть до длины волны 525 нм. Учитывая тот факт, что потери экстинкции при использовании длины волны, не совпадающей с максимумом поглощения, представляют собой постоянную и точно учитываемую величину, а интерференция с мешающим определению билирубином будет меняться в зависимости от его концентрации в сыворотке, выбор в данном случае должен быть сделан в пользу светофильтра 540 нм.
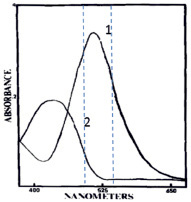
Рис. 2. Спектр поглощения продукта ферментативного определения мочевой кислоты – окрашенного хинонимина (кривая 1) и интерферирующий спектр поглощения примесей билирубина (кривая 2) [4]. Пунктирными линиями отмечено положение максимумов пропускания светофильтров 492 нм и 540 нм, входящих в базовую конфигурацию планшетного фотометра Multiskan MS
Редко, но встречаются спектрофотометрические методы, которые невозможно адаптировать к фотометрам с системой светофильтров – например, когда максимум поглощения аналита представляет собой очень узкий пик с полушириной порядка нескольких нанометров, как это имеет место в дифференциальном спектре поглощения восстановленной/окисленной форм цитохрома С с максимумом при 550 нм [5].
Этап 2. Длину оптического пути, которая в обычных горизонтальных спектрофотометрах всегда равна 1 см, при планшетной фотометрии необходимо рассчитывать исходя из геометрических размеров ячейки и внесенного в нее объема инкубационной смеси. На рис. 3 для примера показаны геометрические характеристики ячеек для стандартных 96-луночных планшетов с плоским дном фирмы Corning (модель 9017).
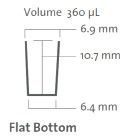
Рис. 3. Геометрические характеристики ячейки 96-луночного планшета с плоским дном Corning 9017 [6]
Как это видно из рис. 3, в планшетах Corning 9017 различия между диаметрами наружного края и дна ячейки составляют всего 0,5 мм, что позволяет рассматривать ее как цилиндр с усредненным диаметром 0,66 см [7] и вывести требуемое уравнение связи между объемом инкубационной смеси (V, мкл) и длиной оптического пути падающего света (h, см): h = 0,0029V. Если точных данных производителя найти не удается, геометрические размеры ячеек можно определить ориентировочно с помощью микрометра или штангенциркуля.
Этап 3. При выборе общего объема инкубационной смеси в ячейках планшета основными являются следующие соображения:
– чем меньше объем, тем существенней экономия реагентов и биоматериала, но тем короче длина оптического пути и соответственно медленней набираются необходимые для анализа изменения оптической плотности во времени; при очень низких объемах увеличивается вклад области, занимаемой мениском, в общую оптическую плотность содержимого ячейки, что может сказаться на разбросе в параллельных пробах;
– при объемах, близких к максимально возможному (360 мкл на рис. 3), увеличивается вероятность искажения мениска и разбрызгивания содержимого ячеек при инкубации на шейкере.
Исходя из этих соображений, для 96-луночных планшетов Corning 9017 (Рис. 3) оптимальным является объем инкубационной смеси 200 мкл и допустимыми – больше 100 и меньше 300 мкл.
Низкие начальные объемы инкубационной смеси выгодны в двух случаях:
– если метод основан на остановке реакции путем резкого изменения рН (исходный объем инкубационной смеси выбирают низким – например, 100 мкл – и добавляют в конце реакции 200 мкл кислоты или щелочи). При этом концентрация аналита в смеси снижается в 3 раза, но одновременно в те же 3 раза увеличивается длина оптического пути, купируя проигрыш от разведения;
– при высоких значениях оптической плотности слепых проб, если изучаемая реакция основана на дальнейшем увеличении оптической плотности (чтобы исключить возможные нарушения закона Бугера – Ламберта – Бера для проб с высокими значениями измеряемого показателя).
Этап 4. Выбор соотношения между добавляемым объемом биологического образца и временем инкубации для кинетических методов, основанных на измерении скорости реакции, зависит от типа используемого планшетного фотометра. К кинетическим методам относятся все методы определения активности ферментов и часть методов определения содержания метаболитов.
Автоматические фотометры сами вносят реагенты и образцы в ячейки планшета и сами измеряют в них оптическую плотность, используя для распределения во времени отдельных шагов подготовленную компьютерную программу. Как правило, для них выбирают небольшое общее время реакции – например, две-три минуты с последовательными измерениями оптической плотности в ячейке каждые 30 с, начиная с окончания небольшого лаг-периода порядка 30–60 с. Эти временные промежутки задаются оператором в программе, и далее автоматический фотометр определяет очередность отдельных шагов сам – одни пробы уже находятся в процессе измерения, в другие только еще добавляются нужные компоненты, а третьи ожидают своей очереди. Объем вносимого в каждую пробу биологического образца при этом нужно подбирать так, чтобы скорость реакции была достаточно высокой и обеспечила быстрое нарастание оптической плотности в течение нескольких минут.
В полуавтоматических фотометрах планшет заполняется вручную и, хотя на заключительном этапе обычно используют 8-канальные пипетки, к моменту заполнения последнего ряда реакция в предыдущих рядах ячеек уже в течение какого-то времени идет – тем дольше, чем ближе ряд расположен к отправному А1-А8. В то же время по истечении времени инкубации показания оптической плотности считываются фотометром за 20–30 с, т.е. практически одновременно. Поэтому при всех прочих соображениях для полуавтоматического планшетного фотометра имеет смысл выбирать достаточно большое время реакции – 30 мин и более, чтобы нивелировать различия в очередности заполнения ячеек планшета. При этом появляется возможность решать проблемы с недостаточными объемами биопроб, увеличивая время реакции до нескольких часов.
Этап 5. Вывод общей формулы для расчета значений измеряемого показателя. Используя выходные данные, полученные на всех этапах процедуры адаптации, можно вывести формулу расчета значений показателя в зависимости от наблюдаемых изменений оптической плотности инкубационной смеси для данной прописи. Для методов оценки активности ферментов формула имеет следующий общий вид:
Е(МЕ/л) = ΔA/мин × (V/Emkm*L*v),
где Е – активность фермента в международных единицах (мкмоль/мин) на литр биопробы, ΔA/мин – скорость изменения оптической плотности инкубационной смеси за 1 мин, V – общий объем инкубационной смеси в литрах, Emkm – микромолярный коэффициент экстинкции аналита, L – длина оптического пути в см, v – добавляемый объем биопробы в литрах. Выражение, находящееся в скобках (V/Em*L*v), в коммерческих клинико-лабораторных прописях часто называют фактором (F) [8].
Заключение
Использование вертикальной планшетной фотометрии, по сравнению с классической горизонтальной, позволяет резко снизить расход биоматериала и реагентов при измерении различных биохимических показателей состояния организма людей и лабораторных животных. Эти преимущества особенно важны при оценке биохимических показателей в гигиенических исследованиях, которые отличаются большим количеством биопроб с широким набором определяемых в них показателей [9–11] и часто лимитируются объемом доступного биоматериала; наиболее проблемными в этом смысле являются санитарно-токсикологические эксперименты на животных, где кровь берется из подъязычной вены в количестве не более 0,5–1 мл [12, 13].
Алгоритм адаптации биохимических методов к условиям планшетной фотометрии, изложенный в данных рекомендациях, предусматривает использование широкого круга моделей планшетных фотометров различной ценовой категории, включая наиболее бюджетные модели полуавтоматических вертикальных фотометров с системой светофильтров, и описывает сходство и различия в процедуре адаптации в зависимости от используемого типа прибора.

