Метилселениновая кислота (МСК) представляет собой соединение селена второго поколения, которое обладает различной биологической и фармакологической активностью [1–3]. Неоднократно показано, что МСК способствует апоптозу различных раковых клеток, вызывая пролонгированный стресс эндоплазматического ретикулума (ЭР-стресс), в результате которого активируется про-апоптотический «мисфолдинг-ответ» (UPR-unfolded protein response). Кроме того, МСК способна регулировать экспрессию селенопротеинов, локализующихся в ЭР, что весьма интересно, учитывая важную роль селена и селенопротеинов в регуляции процессов канцерогенеза [4–8]. Известно, что 7 из 25 селенопротеинов, идентифицированных у млекопитающих, являются резидентами ЭР, их роль в регуляции процессов, сопряженных с ЭР-стрессом, неоднократно доказана в ряде исследований [1–3]. В центре внимания данной работы находится малоизученный селенопротеин человека SELI, который также локализуется в ЭР, а его мРНК экспрессируется в исследуемых раковых клетках в значительной степени, как нами было ранее показано [9].
Цель исследования: исследовать изменение уровней экспрессии мРНК гена hseli и определить количественное содержание белка SELI в раковых клетках человека DU 145, HT-1080 и MCF 7 в условиях ЭР-стресса, вызванного воздействием на клетки МСК.
Материалы и методы исследования
Выделение РНК. Тотальную РНК из раковых клеток DU 145, HT-1080 и MCF 7 («ATCC», США) выделяли с помощью реагента Extract tRNA reagent («Евроген», Россия), содержащего раствор фенола и гуанидинизотиоционата. Реагент вносили на чашку Петри с клеточным монослоем из расчета 1 мл на 10 см2 поверхности, выделение РНК согласно протоколу производителя.
Обратная транскрипция. Реакцию обратной транскрипции проводили с использованием набора реагентов для синтеза первой цепи кДНК («Евроген», Россия), содержащего ревертазу MMLV в присутствии oligo(dT)-праймеров. Используемое в реакции содержание суммарной РНК (2 мкг) контролировали, проводя параллельно амплификацию с праймерами к гену «домашнего хозяйства» GAPDH.
ПЦР в реальном времени. Полученную к ДНК использовали в качестве матрицы для проведения ПЦР в реальном времени с помощью смеси qPCRmix-HSSYBR («Евроген», Россия) и пар праймеров: для гена hgapdh 5’ AACGGGAAGCTCACTGGC 3’ и 5’ CACCACCCTGTTGCTGTAGC 3’; для гена hseli 5’ CCAAATGAGTAGTACCCGGTG 3’ и 5’ CCAAAGAAAGATTATTACAGGCC 3’. ПЦР в реальном времени проводили в следующем режиме: предварительная денатурация при 95 °C, 2 мин, далее 35 циклов в режиме 95 °C 1 мин, 60 °C 30 сек и 72 °C 30 сек. Изменение уровня экспрессии мРНК до и после обработки МСК, определяли по формуле ОУЭ = 2-ΔΔСт, где ΔСт – разница между значениями пороговых циклов для референсного (GAPDH-ген, кодирующий глицеральдегид-3-фосфат дегидрогеназу) и целевого гена hseli, ΔΔСт – разница значений ΔСт до и после обработки клеток МСК. Результаты приведены как среднее значение ± стандартное отклонение трех независимых экспериментов. Различия считались значимыми, когда значение Р < 0,05. Каждый цикл эксперимента (выделение РНК, реакция обратной транскрипции, ПЦР в реальном времени) повторяли трижды.
Вестерн-блоттинг. Для идентификации исследуемых белков использовали метод иммуноблотинга, для чего клетки отмывали фосфатно-солевым буфером и центрифугировали при 1 000 об/мин в течение 20 мин. Супернатант концентрировали с помощью центрифужных концентраторов Amicon Ultra 4-50 кДа («MerkMillipore», Россия), полученные образцы использовали для проведения ПААГ электрофореза в 10 % разрешающем геле. Далее выполняли иммуноблотинг с коммерческими антителами против исследуемых белков и вторичными антителами, конъюгированными с пероксидазой хрена («Abcam», США). Количественная обработка результатов вестерн-блоттинга проводилась с помощью программы «ImageJ» [https://imagej.nih.gov/ij/index.html].
Результаты исследования и их обсуждение
Анализ экспрессии мРНК гена hseli в исследуемых раковых клетках после воздействия на них 0,01; 0,1 и 1 мкМ МСК в течение 24 и 48 ч
Ранее нами и др. авторами показано, что МСК в концентрациях 0,01; 0,1 и 1 мкМ способна вызывать ЭР-стресс, причем в различных раковых клетках механизм регуляции ЭР-стресса и про-апоптотического UPR может протекать с участием трех трансмембранных белков PERK, IRE1 и ATF-6 [1–3]. Недавно нами установлено, что при обработке раковых клеток DU 145, HT-1080 и MCF 7 в течение 24 и 48 ч 0,01; 0,1 и 1 мкМ МСК % цитотоксичности всех трех линий раковых клеток увеличивался прямо пропорционально концентрации МСК и времени обработки.
Таким образом, измерение уровней экспрессии мРНК и количественная оценка белка SELI проводились в условиях пролонгированного стресса, приводящего в конечном итоге к апоптозу клеток. Результаты, полученные с помощью метода ПЦР в реальном времени (рис. 1), свидетельствуют об усилении экспрессии мРНК гена hseli во всех трех линиях особенно после воздействия на клетки 1 мкМ МСК, кроме того почти двукратное увеличение экспрессии данного гена наблюдалось после обработки клеток HT-1080 0,01 и 0,1 мкМ МСК.
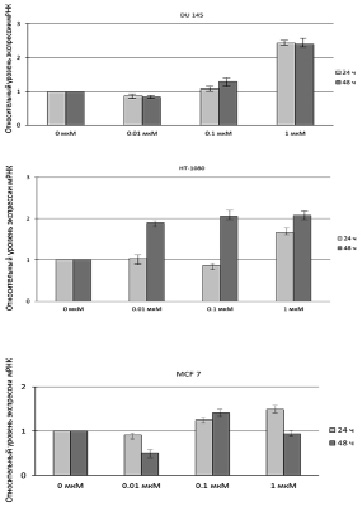
Рис. 1. Относительный уровень экспрессии мРНК гена hseli в клетках DU 145, HT-1080 и MCF 7 до и после обработки клеток 0,01; 0,1 и 1 мкМ МСК в течение 24 и 48 ч
Это может быть объяснено тем, что данная клеточная линия является слабо дифференцированной по сравнению с DU 145 и MCF 7, для которых показатель цитотоксичности при обработке их исследуемыми концентрациями МСК, как было показано ранее, оказался ниже, чем для HT-1080. Таким образом, количество апоптотических клеток для линии HT-1080 после воздействия на них 0,01; 0,1 мкМ МСК приблизительно соответствует таковому после воздействия на клетки DU 145 и MCF 7 0,1 и 1 мкМ МСК. Результаты, полученные с помощью ПЦР в реальном времени, коррелируют с результатами вестерн-блоттинга, представленными на рис. 2 и 3.

Рис. 2. Содержание белка SELI в клетках DU 145, HT-1080 и MCF 7 до и после их обработки МСК. 1 – содержание белка в интактных клетках; 2,4,6 – содержание белка после 24 ч обработки клеток 0,01; 0,1; 1 мкМ МСК, соответственно; 3,5,7 – содержание белка после 48 ч обработки клеток 0,01; 0,1; 1 мкМ МСК соответственно
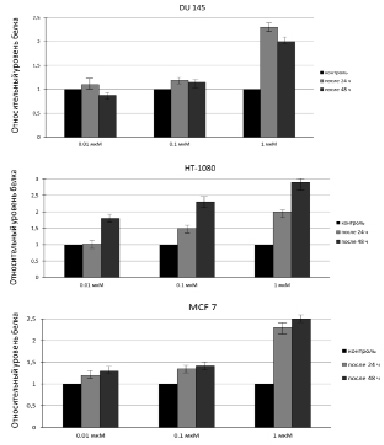
Рис. 3. Относительный уровень содержания белка в клетках DU 145, HT-1080 иMCF 7 до и после 24 ч или 48 ч обработки МСК. Анализ выполнен с помощью программы «ImageJ»
Заключение
SELI является плохо изученным селенопротеином млекопитающих, наряду с семью другими селенопротеинами-резидентами ЭР, также локализуется в данном органоиде клетки. В связи с чем возник интерес исследовать изменение экспрессии мРНК его гена, а также дать количественную оценку содержания белка SELI в трех раковых клеточных линиях человека DU 145, HT-1080 и MCF 7 в условиях ЭР-стресса, вызванного воздействием на клетки различными концентрациями МСК. В результате ряда экспериментов установлено, что во всех трех клеточных линиях наблюдалось усиление экспрессии мРНК и белка соответственно после воздействия на них 1 мкМ МСК, однако в клетках HT-1080 аналогичные изменениях экспрессии наблюдались и при воздействии на них более низкими концентрациями МСК (0,01 и 0,1 мкМ). На основании полученных результатов с учетом внутриклеточной локализации SELI, можно предположить, что данный селенопротеин вовлечен в регуляцию процессов, сопряженных с ЭР-стрессом, в том числе пролонгированным, приводящим к апоптозу раковых клеток, как это было продемонстрировано в ряде работ [1–5]. Данные результаты послужат предпосылкой для дальнейших исследований функций SELI и его вклада в регуляцию процессов ЭР-стресса и канцерогенеза.
Работа выполнена при поддержке гранта РФФИ № 18-34-00118 мол_а и гранта Президиума РАН «Постгеномные технологии и перспективные решения в биомедицине».

