Позитронная эмиссионная томография (ПЭТ) – информативный метод медицинской визуализации, входящий в группу методов ядерной медицины (радионуклидной диагностики). Использование ПЭТ дает огромные возможности для in vivo диагностики онкологических заболеваний – стадирования и уточнения размеров опухоли, выявления рецидивов и метастазов после проведенного лечения, областей некроза, планирования и оценки эффективности противоопухолевой терапии [1]. В качестве радиофармпрепаратов (РФП) в ПЭТ используют биологически активные соединения, меченные короткоживущими радионуклидами с позитронным типом распада, среди которых широкое применение получили изотопы 18F (Т1/2 110 мин), 11С (Т1/2 20.4 мин). [2]. В настоящее время подавляющее большинство исследований методом ПЭТ проводят с использованием 2-[18F]фтор-2-дезокси-D-глюкозы ([18F]ФДГ), которая является фторированным аналогом D-глюкозы, меченной изотопом фтора-18 [3]. В организме человека [18F]ФДГ фосфорилируется подобно глюкозе, однако, в отличие от нее, не участвует в последующих стадиях метаболизма и накапливается в клетке. Эта особенность поведения фторированного аналога, а также удобный для проведения ПЭТ исследований период полураспада входящего в его состав радиоактивного изотопа позволяют получать уникальную информацию о региональной скорости потребления глюкозы в нормальной и патологически измененной ткани [4]. Предложенный в 1977 году в Брукхевенской национальной лаборатории данный радиотрейсер до сих пор остается абсолютным рекордсменом по числу проведенных с его участием ПЭТ исследований.
Ограничением ПЭТ-диагностики с помощью ФДГ является повышенное накопление препарата серым веществом мозга, что не дает возможности применения этого РФП для диагностики церебральных опухолей. Для этой цели наибольшее применение получил меченый аналог аминокислоты L-[11C-метил]метионин ([11C]MET), его накопление в клетках опухоли обусловлено увеличением концентрации транспортеров LAT1. Перерождение нормальной клетки в раковую сопровождается интенсификацией потребления аминокислот для синтеза белков, деления и получения энергии. У раковых клеток гиперэкспрессированы белки, ответственные за активный транспорт аминокислот. Поэтому меченые аминокислоты и их аналоги являются важным инструментом визуализации в онкологии [3]. В ИМЧ РАН накоплен более чем 30-летний опыт применения [18F]ФДГ и [11C]MET. Для эффективного использования вышеуказанных РФП были разработаны автоматизированные методы синтеза и контроля качества [5–7].
Радиофармпрепараты могут быть допущены для инъекции человеку только после аналитического подтверждения параметров контроля качества, описанных в нормативной документации. Одним из таких параметров является анализ на остаточные органические растворители (ООР). Контролю на содержание органических растворителей подлежат лекарственные препараты независимо от способа применения, если при их получении или очистке используются органические растворители или они могут образоваться в процессе производства [8]. Как правило, в фармацевтической индустрии для количественного определения ООР используется метод газовой хроматографии с пламенно-ионизационным детектором с применением предварительных методик концентрирования летучих примесей (GC head space analysis) или прямого анализа препарата [9–11]. В некоторых случаях подобрать единый метод анализа всех примесей сразу крайне сложно, поскольку концентрации могут отличаться в сотни и тысячи раз. К примеру, содержание этанола как добавки, необходимой для растворения липофильных РФП, может достигать 12% [11]. Для уверенности в правильности полученных данных метод анализа должен быть валидирован [9–11]. Валидация аналитической методики – это экспериментальное доказательство того, что методика пригодна для решения предполагаемых задач [12]. Целью данной работы являются разработка и валидация методики определения ООР ацетонитрила и этанола в радиофармпрепаратах [18F]ФДГ и [11C]MET, синтезированных в ИМЧ РАН.
Материалы и методы исследования
Безводный бескислотный ацетонитрил (max 10 ppm H2O) был приобретен в компании «Криохим», Санкт-Петербург. Этиловый спирт (95%) имел квалификацию «Этанол медицинский», производитель ООО «РОСБИО», Санкт-Петербург. Вода, использованная для приготовления стандартных растворов, была очищена на установке Milli-Q Simplicity, Millipore, до удельного сопротивления 18х106 Ом х см. Стандартные растворы для калибровки были приготовлены путем разбавления точной навески растворителей водой Milli-Q в мерных колбах.
Таблица 1
Параметры систем хроматографа для методик анализа этанола и ацетонитрила
|
Параметры |
Методика |
|
|
Этанол |
Ацетонитрил |
|
|
Гелий, мл/мин |
25 мл/мин |
25 мл/мин |
|
Водород, мл/мин |
25 мл/мин |
25 мл/мин |
|
Воздух, мл/мин |
250 мл/мин |
250 мл/мин |
|
Т°С колонки |
180 °C |
200 °C |
|
Т°С инжектора |
200 °C |
200 °C |
|
Т° Детектора (ПИД) |
200 °C |
200 °C |
|
Время удерживания |
5,08 мин |
11,84 мин |
Анализ выполняли на газовом хроматографе марки «Хроматек-Кристалл 5000», оснащенном ионизационно-пламенным детектором (ПИД) и автосамплером ДАЖ-2М, с использованием встроенных программ «Хроматэк Аналитик 3». Применялись газы высокой чистоты: гелий (99,999%) и водород (водородный генератор входит в комплектацию хроматографа). Сжатый воздух подавался промышленным компрессором Atlas Corso, установленным в ИМЧ РАН. Использовалась колонка Porapak QS 80/100, длиной 2 м, диаметром 3 мм (Scientific, США). Объем анализируемой пробы составлял 1 мкл. Параметры двух хроматографических методик приведены в таблице 1.
В качестве стандартных образцов использовали свежеприготовленные водные растворы этанола 8 мг/мл и ацетонитрила 0,3 мг/мл. Для определения параметра линейности использовали пять растворов разной концентрации в области 2–15 мг/мл для этанола и 0,05–1 мг/мл для ацетонитрила, по три введения на каждую точку.
Синтез [18F]ФДГ
[18F]Фторид получают ядерной реакцией 18O(p,n)18F при облучении [18O]H2O (97% обогащения, Глобальные Научные Технологии, Сосновый Бор, Россия) в серебряной водной мишени (1,4 мл) циклотрона PETtrace 4 с энергией протонов 16.4 MeV (GE Healthcare, Швеция). По окончании облучения облученная [18O]H2O, содержащая [18F]фторид, доставляется током гелия из мишени в модуль синтеза [18F]ФДГ. Полученный радионуклид стабилизируется в химической форме 18F-фторид-иона, который выделяют из облученной воды сорбцией на анионообменной смоле с последующим элюированием раствором, содержащим комплекс криптанда К2.2.2 с и карбоната калия в смеси CH3CN/H2O 96/4, согласно ранее разработанной методике [6]. После удаления растворителей в токе азота при 130оС радионуклид в составе активированного комплекса [К 2.2.2]К+18F- используют в реакции нуклеофильного радиофторирования. На этой стадии задействуют 10–12 мг предшественника 1,3,4,6-тетра-О-ацетил-2-О-трифторметансульфонил-β-D-маннопиранозы и безводный ацетонитрил в качестве растворителя. На второй стадии (гидролиз и снятие защитных групп) используют 0,3 М NaOH (рис. 1). Детали синтеза приводятся в работе [6].
Синтез [11С]MET
Процесс производства изотопа 11С происходит по ядерной реакции 14N(p, α)11C при облучении протонами газовой смеси 99,5% азота и 0,5% кислорода в мишени циклотрона, при этом углерод-11 стабилизируется в форме 11СО2. Методика получения [11С]MET основывается на реакции S-11С-метилирования с помощью [11С] CH3I. Последний получали так называемым мокрым методом, основанным на реакции восстановления [11С]CО2 литий алюминий гидридом (LiAlH4) с последующей конверсией образовавшегося промежуточного продукта [11С]CH3ОLi в [11С]CH3ОН и далее в [11С]CH3I при нагревании с HI (57% водный раствор). В качестве субстрата для S-11С-метилирования выступает L-гомоцистентиолактон, который в щелочной среде образует L-гомоцистеин, схема синтеза представлена на рисунке 2.
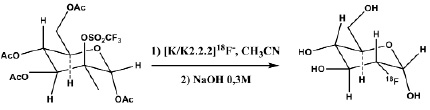
Рис. 1. Схема синтеза [18F]ФДГ
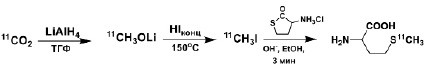
Рис. 2. Схема синтеза [11С]MET
Процесс S-11С-метилирования происходит в режиме online на одноразовом картридже tC18 путем пропускания летучего [11С] CH3I. На картридж предварительно наносятся водный раствор L-гомоцистентиолактона и водно-этанольный раствор NaOH. По завершении реакции S-11С-метилирования полученный [11С]MET смывают с картриджа водным раствором фосфата натрия. Синтез [11С]MET подробно описан в работе [5].
Результаты исследования и их обсуждение
Остаточные органические растворители (ООР) – легко летучие органические вещества, используемые при производстве РФП. При разработке синтеза выбор подходящего растворителя обусловлен такими характеристиками, как малая токсичность, хорошая растворимость реагентов в нем, а также возможность его максимального удаления после реакции для обеспечения чистоты конечного продукта. Содержание ООР в РФП является критическим параметром, требующим контроля и соответствия требованиям государственной фармакопеи РФ.
В общей фармакопейной статье «Остаточные органические растворители» [8] выделено три класса органических растворителей, допустимых к использованию в производстве лекарственных средств. Предельно допустимое содержание ООР определяется степенью их возможного риска для здоровья человека. Ацетонитрил относится ко 2-му классу (негенотоксичные растворители), этанол – к 3-му классу (растворители с низкой токсичностью). Параметры растворителей представлены в таблице 2.
Ацетонитрил применяется в синтезе [18F]ФДГ на первой стадии, как растворитель при проведении нуклеофильного [18F]фторирования, после чего упаривается до минимально возможного количества перед проведением второй стадии – гидролиза. При разработке синтеза в ИМЧ РАН было доказано, что автоматизированная технология позволяет уменьшить содержание ацетонитрила в конечном продукте до значений ниже, чем указано в Фармакопее. Нормативная документация ИМЧ РАН на РФП [18F]ФДГ устанавливает более строгий предел относительно нормативов Фармакопеи (табл. 2), а именно 300 ppm (мг/л), или 0,3 мг/мл.
Этанол имеет двойное применение в синтезе [11С]MET: во-первых, как органический растворитель, который необходим для улавливания [11С] CH3I на картридже tC18; во-вторых, при кондиционировании одноразовых картриджей для финальной очистки конечного продукта и линии фасовки. При разработке синтеза было определено предельно допустимое содержание этанола в [11С]MET – 8 мг/мл, или 0,8%. Согласно ОФС (табл. 2), для растворителей 3-го класса регламентирована процентная концентрация – 0,5% от общего объема вводимого препарата, если же их содержание может превышать 0,5%, то требуются подтвержденная идентификация и количественное определение. Поэтому в нормативную документацию ИМЧ РАН на РФП [11С]MET был внесен параметр «содержание этанола» с допустимым пределом не более 8 мг/мл.
Предложенные авторами методики определения ацетонитрила и этанола были валидированы в соответствии с требованиями ОФС [12]. ОФС определяет необходимость оценки аналитических характеристик в зависимости от задачи исследования, как описывается в таблице 3.
Для определения ООР в РФП применима методика «Предел содержания», поскольку в нормативную документацию внесено предельное значение 0,3 мг/мл для ацетонитрила в [18F]ФДГ и 8 мг/мл для этанола в [11С]MET. В этом случае необходимо подтверждение следующих характеристик: специфичность, предел обнаружения, правильность (при необходимости) и устойчивость (при необходимости).
Специфичность – это способность аналитической методики однозначно оценивать определяемое вещество в присутствии сопутствующих компонентов. Доказательство специфичности валидируемой методики основывается на рассмотрении данных анализа модельных смесей известного состава [12, с. 3].
Таблица 2
Предельное содержание ООР согласно [8]
|
Растворитель |
Класс токсичности |
Темп. кипения (оС) |
Предельное содержание, мг/сутки |
Предельное содержание, ppm |
|
Ацетонитрил |
2 |
82 |
4,1 |
410 |
|
Этанол |
3 |
78 |
50* |
5000* |
Примечание: *при превышении значения требуются идентификация и количественное определение.
Таблица 3
Характеристики методик, определяемые при валидации [12, с. 2]
|
Характеристика |
Типы методик |
||||
|
Подлинность |
Посторонние примеси |
Количественное определение |
|||
|
Количеств.методики |
Предел содержания |
основного действующего вещества, нормир. компонентов |
действующего вещества в тесте «Растворение» |
||
|
Специфичность**) |
Да |
Да |
Да |
Да |
Да |
|
Предел обнаружения |
Нет |
Нет |
Да |
Нет |
Нет |
|
Предел количест. определения |
Нет |
Да |
Нет |
Нет |
Нет |
|
Аналит. область |
Нет |
Да |
Нет |
Да |
Да |
|
Линейность |
Нет |
Да |
Нет |
Да |
Да |
|
Правильность |
Нет |
Да |
* |
Да |
Да |
|
Прецизионность: – повторяемость (сходимость) |
Нет |
Да |
Нет |
Да |
Да |
|
– промежуточная (внутрилаборат.) прецизионность |
Нет |
Да |
Нет |
Да |
Нет |
|
Устойчивость |
Нет |
* |
* |
* |
* |
Примечание: *может определяться при необходимости; **отсутствие специфичности одной аналитической методики может быть компенсировано использованием другой аналитической методики
Сопутствующими компонентами являются: в случае [18F]ФДГ – раствор хлорида натрия, для [11С]MET – раствор фосфата натрия. При разработке методики было показано, что площади пиков и времена удерживания ООР не зависят от того, растворяют ли стандарты в воде или в изотонических растворах, т.е. методика является специфичной.
Предел обнаружения – это наименьшее количество (концентрация) определяемого вещества, которое может быть обнаружено (или приближенно оценено) с использованием валидируемой методики [12, с. 4]. ГЖХ с ионизационно-пламенным детектором – очень чувствительный метод. В нашем случае значения концентраций ООР достаточно высоки и минимум на два порядка превышают значения предела обнаружения. Для таких случаев в ОФС [12, с. 5] есть уточнение: «Если имеются данные о пригодности методики для надежного определения вещества в концентрациях, лежащих как выше, так и ниже нормы его содержания, установленной спецификацией, определять реальный предел обнаружения для такой методики не требуется». Поскольку для определения правильности (см. далее) авторами была доказана линейность методики (рис. 3), это снимает задачу выяснения реального предела обнаружения.
Правильность. Методика признается правильной, если значения, принимаемые за истинные, лежат внутри доверительных интервалов соответствующих средних результатов анализов [12, с. 9]. Это возможно оценить при рассмотрении результатов изучения линейности валидируемой методики, а именно насколько величина достоверной аппроксимации R2 близка к единице.
Устойчивость (робастность) – мера способности методики сохранять рабочие характеристики при небольших, но неслучайных изменениях параметров [13]. При разработке методики была показана ее высокая устойчивость, поскольку методика почти полностью автоматизирована. Пробы подвергаются анализу без предварительной обработки (отсутствует возможность ошибки пробоподготовки), параметры хроматографического анализа задаются автоматически, введение проб осуществляется автосамплером.
Для определения параметра линейности применяли пять растворов следующих концентраций: для ацетонитрила – 0,05; 0,10; 0,32; 0,60 и 1,00 мг/мл, для этанола – 2,0; 6,0; 8,0; 10,0 и 15,0 мг/мл, три повторения на каждую точку.
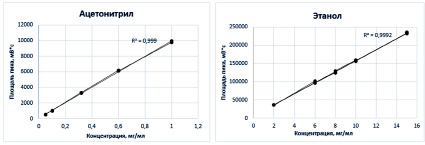
Рис. 3. Определение параметра линейности методики для ацетонитрила и этанола
Было показано, что методики являются линейными в обоих случаях, для ацетонитрила величина достоверной аппроксимации R2 = 0,999, для этанола R2 = 0,992 (рис. 3). Данное значение свидетельствует о соответствии параметру «Правильность» и высокой пригодности методики.
Методика применяется в рутинной работе на газовом хроматографе «Хроматек-Кристалл 5000» с автосамплером ДАЖ-2М. Встроенная программа «Хроматэк Аналитик 3» позволяет непрерывно проводить анализ серии образцов после выбора метода, оформления таблицы проб и их установки в автосамплер в последовательности, ранее прописанной в таблице. После подготовки и запуска анализ возможен в отсутствие оператора. Хроматограммы и отчеты по ним автоматически сохраняются в компьютере. Программно-аппаратный комплекс ГХ с автосамплером сокращает время анализа пробы, позволяет применять данный метод в автоматическом режиме в отсутствие оператора, что обеспечивает его скорость, точность, воспроизводимость и безопасность.
Свежеприготовленные стандарты ацетонитрила 0,3 мг/мл и этанола 8 мг/мл помещают в чистые виалы, устанавливают в автосамплер и анализируют трижды, при этом отклонения площади пиков должны быть менее 5%. Затем в автосамплер устанавливают образцы для анализа и подвергают каждый образец тройной инъекции. Площади пика на хроматограммах вычисляют с помощью встроенного в программу электронного интегратора. По окончании записи хроматограммы концентрации ацетонитрила или этанола автоматически рассчитываются по методу сравнения площади пика в исследуемой пробе со стандартным раствором. Если концентрация исследуемого растворителя в препарате ниже предельно допустимой: 0,3 мг/мл для ацетонитрила и 8 мг/мл для этанола, то исследуемый РФП соответствует требованиям качества по данному параметру.
Заключение
В данной работе была разработана методика определения ООР ацетонитрила и этанола методом газожидкостной хроматографии с пламенно-ионизационным детектором. Методика валидирована в соответствии с требованиями Общей Фармакопейной Статьи и принадлежит к типу «Предел содержания». В нормативную документацию ИМЧ РАН внесено предельное значение 0,3 мг/мл для ацетонитрила для РФП [18F]ФДГ и 8 мг/мл для этанола для [11С]MET. Методика обладает высокой линейностью (R2 > 0,99) в аналитической области 2–15 мг/мл для этанола и 0,05–1 мг/мл для ацетонитрила и успешно применяется в контроле качества РФП [18F]ФДГ и [11С]MET.

