Постинфекционное поражение почек включает в себя несколько типов патологических проявлений, в число которых входят: гломерулонефрит, тубулоинтерстициальный нефрит и острый канальцевый некроз. Из них постинфекционный гломерулонефрит связан с иммунологическим ответом на инфекцию и опосредуется различными агентами, такими как бактерии, вирусы, грибы и паразиты [1].
Необходимо отметить, что на протяжении более 100 лет диагноз «острый постстрептококковый гломерулонефрит» был синонимом диагноза «гломерулонефрит, ассоциированный с бактериальной инфекцией», поскольку другие варианты постинфекционных бактериальных гломерулонефритов в клинической практике наблюдались исключительно редко [2]. Однако за последние несколько десятилетий произошли кардинальные изменения в эпидемиологии и бактериологии постинфекционных гломерулонефритов. Так, заболеваемость гломерулонефритом, ассоциированным со стрептококковой инфекцией, в развитых странах резко снизилась, в то время как число случаев гломерулонефритов, ассоциированных со стафилококковой инфекцией, в частности, вызванных золотистым стафилококком, существенно увеличилось [1, 3, 4]. Вероятным фактором, способствующим этому, по мнению исследователей, является, прежде всего, всплеск стафилококковых инфекций, главным образом вызванных золотистым стафилококком с лекарственной устойчивостью. Кроме того, отмечается, что изменение ведущего этиологического фактора в патогенезе постинфекционных гломерулонефритов связано с ростом числа пожилых пациентов, имеющих сопутствующие заболевания, такие как сахарный диабет и ожирение [5]. Среди причин, которые способствуют развитию стафилококкового гломерулонефрита, указывается увеличение длительного использования центральных катетеров, имплантатов и кардиологических устройств [2]. Более того, некоторые авторы высказывают предположение о том, что стафилококковый гломерулонефрит со временем станет основным видом заболевания среди всех постинфекционных гломерулонефритов, включая небактериальные формы [1].
В настоящее время установлено, что из всех постинфекционных стафилококковых гломерулонефритов на долю S. aureus приходится 81,7% случаев, на втором месте авторы отмечают S. epidermidis, на долю которого приходится лишь 11,5%, в то время как другие виды стафилококков, как правило, не являются этиологическим фактором постинфекционного стафилококкового гломерулонефрита [6].
Использование только клинического, биопсийного и аутопсийного материала далеко не всегда позволяет в достаточной мере изучить патогенез заболевания, поэтому в практике патофизиологических исследований широко применяются различные экспериментальные модели.
По своим патогенетическим механизмам выделяют гломерулонефриты: 1) опосредованные воздействием иммунных комплексов; 2) опосредованные образованием антител к гломерулярной базальной мембране; 3) ассоциированные с антинейтрофильными цитоплазматическими аутоантителами; 4) опосредованные фактором комплемента С3 [7]. Каждый из этих четырех патогенетических вариантов гломерулонефритов был изучен, в том числе, и на моделях животных. Известны классические модели гломерулонефритов с введением кроличьих антител против гомогенизированной ткани почки крысы другим крысам [8] путем неоднократного введения соединений, состоящих из гетерологичного материала клубочковых базальных мембран (полученного от кроликов, крыс и людей) и адъюванта Фрейнда [9]. Гломерулонефрит, ассоциированный с антинейтрофильными цитоплазматическими аутоантителами, получен в модели [10]. Относительно недавно была описана категория гломерулопатий, опосредованных фактором комплемента С3, впервые выявленная у животных, которая до создания этой диагностической категории часто объединялась с иммуноглобулин-опосредованным гломерулонефритом [11]. Наиболее распространенным первичным гломерулонефритом является IgA-нефропатия. Отличительной чертой заболевания является мезангиальное отложение IgA1-иммунных комплексов, что также было продемонстрировано на экспериментальной модели [12].
Несмотря на то что известные модели позволяют детально исследовать разные патогенетические механизмы, приводящие к развитию гломерулонефрита, влияние стафилококковой инфекции, которая длительное время не привлекала внимание большинства исследователей, а также возможные особенности патогенеза поражения почек при длительной персистенции S. aureus остаются практически неизученными. Отчасти это может быть связано с отсутствием модели, которая помогла бы расшифровать особенности поражения организма при наличии фокальной персистирующей инфекции. Не исключено, что постинфекционный стафилококковый гломерулонефрит является частным случаем описанного в 2002 г. Н.И. Команденко с соавторами синдрома сочетанных дистрофически дегенеративных изменений мезенхимальных производных при локальном хроническом воспалительном процессе [13].
Учитывая, что постинфекционный стафилококковый гломерулонефрит имеет некоторые особенности развития, а именно возникает в более зрелом и пожилом возрасте, часто сопровождается изменениями со стороны других органов и систем, для более точного понимания особенностей течения данного заболевания, а также для оптимизации и большей эффективности проводимых лечебных мероприятий требуется более тщательное изучение особенностей его патогенеза. Существенному прогрессу в решении проблемы адекватного лечения постинфекционного стафилококкового гломерулонефрита может способствовать метод экспериментального моделирования данной патологии.
Цель исследования: создание экспериментальной модели постинфекционного стафилококкового гломерулонефрита.
Материалы и методы исследования
Развитие постинфекционного стафилококкового гломерулонефрита наблюдалось у 18 половозрелых крыс-самцов линии Вистар с исходной массой тела 180–220 г, у которых предварительно был воспроизведен остеомиелит большеберцовой кости с помощью суточной культуры S. aureus (штамм 209), а также развился синдром дистрофически-дегенеративных изменений мезенхимальных производных [14]. В качестве контроля использовали 6 интактных животных, содержащихся в аналогичных условиях вивария. Все манипуляции, необходимые по протоколу эксперимента, выполняли с соблюдением принципов гуманности, изложенных в директивах Европейского сообщества (86/609/ЕЕС) и Хельсинкской декларации по защите позвоночных животных, используемых для лабораторных и иных целей.
Экспериментальные животные были распределены на 3 группы (по 6 особей в группе) и выводились из эксперимента через 1, 2 и 3 месяца после инфицирования S. aureus соответственно. Гистологический материал сразу после декапитации помещали в забуференный нейтральный 12%-ный формалин. Материал большеберцовой кости перед дегидратацией и заливкой в парафин подвергали декальцинации в водном растворе динатриевой соли этилендиаминтетрауксусной кислоты (EDTA). Морфологическое изучение препаратов почки проводили после окрашивания срезов толщиной 5 мкм гематоксилином Эрлиха и эозином. Морфометрический анализ изучаемых структур осуществляли на цифровых микрофотографиях, полученных с помощью микроскопа Микромед-6, цифровой камеры DSM 510 и программного обеспечения ImageJ 1.42g. При этом определялись относительные площади, занимаемые почечным тельцем, капиллярным клубочком, пространством капсулы, включениями (слущенными клетками, форменными элементами, белком, в том числе фибрином и т.д.) на 10 микрофотографиях (площадь каждой из которых составляла 10000 мкм2 – увеличение х400). Также подсчитывались количество почечных телец и относительная площадь, занимаемая этими почечными тельцами на 6 микрофотографиях (площадь каждой составляла 97200 мкм2 – увеличение х100), для каждого животного. Статистический анализ осуществлялся с помощью программного пакета SPSS v 17.0 for Windows. Рассчитывали медианы и интерквартильный размах (Me (Q1 – Q3)). Сравнение независимых групп осуществляли с использованием критерия Краскела–Уоллиса с последующим сравнением пары независимых групп с использованием критерия Манна–Уитни.
Результаты исследования и их обсуждение
Гистологическое изучение препаратов большеберцовой кости через 1 месяц после инфицирования 209 штаммом S. aureus позволило выявить характерные морфологические признаки остеомиелита. Так, в зоне трепанационного отверстия и введенной в него хлопчатобумажной нити определялись обширные участки с дегенеративно-измененными лимфоцитами, очаги некроза, краевая резорбция костных балок (рис. 1А). Также отмечалась воспалительная реакция со стороны периоста и эндоста.
При оценке препаратов коркового вещества почек обращено внимание, что через 1 месяц после инфицирования у 50% экспериментальных животных определялись лимфоцитарные инфильтраты как в области почечных телец, так и в зоне извитых канальцев (рис. 1В). Вполне вероятно, что данный факт следует расценивать как следствие имеющей место преходящей бактериемии, которая могла наблюдаться из-за несовершенства барьерной функции макрофагально-фиброцитарного вала в очаге развившегося остеомиелита через 1 месяц после инфицирования.
На этом фоне почечные клубочки были часто деформированы, в пространстве капсулы Шумлянского–Боумена нередко выявлялось эозинофильное бесструктурное вещество, представляющее собой белковые отложения (в том числе скопления фибрина) с находящимися в них слущенными эпителиальными клетками, эритроцитами.
Несмотря на имеющиеся изменения со стороны клубочкового аппарата, почечные тельца в корковом слое почек не подверглись редукции и их количество на тестируемой площади достоверно не отличалось от аналогичного показателя у интактных животных (р=0,219).
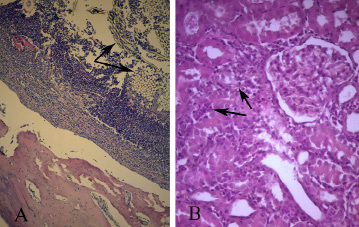
Рис. 1. А) Фрагмент большеберцовой кости крысы через 1 месяц после инфицирования S. aureus. В зоне трепанационного отверстия и введенной в него хлопчатобумажной нити (отмечено стрелками) определяются обширные участки с дегенеративно-измененными лимфоцитами, очаги некроза, краевая резорбция костных балок Окраска гематоксилином и эозином. Ув. х100. В) Участок коркового вещества почек через 1 месяц после инокуляции S. aureus. Инфильтрация лимфоцитарными элементами околоклубочковой области с захватом зоны извитых канальцев (отмечено стрелками). Деформация почечного тельца и почечного клубочка. Окраска гематоксилином и эозином. Ув. х400
Вместе с тем, наблюдалось сморщивание почечных телец, подтверждаемое достоверным уменьшением их диаметра. Так, относительная площадь, занимаемая почечными тельцами, была в 1,22 раза меньше, чем у группы интактных животных (р=0,00016). Данные морфометрического анализа показателей, отражающих патологические и компенсаторные изменения в почках через 1 месяц после инфицирования экспериментальных животных, представлены в таблице 1.
При оценке строения капиллярного клубочка обращают на себя внимание изменения как со стороны его стенки, так и диаметра самих капилляров, которые были статистически значимо меньше, чем в группе сравнения (р<0,000001). Наблюдалось значительное уменьшение количества эпителиальных клеток (так, количество ядросодержащих клеток почечного клубочка уменьшилось в 2,25 раза по сравнению с интактными животными).
Гистологическое изучение препаратов большеберцовой кости через 2 месяца после инфицирования 209 штаммом S. aureus позволило не только подтвердить наличие остеомиелита, но и выявить признаки, которыми можно было охарактеризовать данный воспалительный процесс как хронический. Зона некроза, располагающаяся в области введения хлопчатобумажных нитей с суточной культурой S. aureus, ограничивалась большими скоплениями лимфоцитарных и, что характерно, макрофагальных элементов. В костной ткани вблизи от макрофагально-фибробластического барьера определялось большое количество пустых лакун, дегенеративно-измененных и некротизированных остеоцитов (рис. 2А).
При оценке препаратов коркового вещества почек определилось, что через 2 месяца после инфицирования, в отличие от предыдущего срока, наблюдается уменьшение количества лимфоцитарных инфильтратов в области почечных телец. Так, они были выявлены всего у одного животного, что составило 16,7%. Данный факт, по всей видимости, был обусловлен формированием достаточно функционально полноценного макрофагально-фибробластического барьера, который способствует значительному снижению бактериальной нагрузки на организм. Однако необходимо отметить, что, несмотря на уменьшение вероятности бактериемии у экспериментальных животных, через 2 месяца после инфицирования S. aureus изменения со стороны почечных клубочков продолжали сохраняться: отмечались их сморщивание и деформация (рис. 2В).
Таблица 1
Морфометрические показатели, характеризующие изменения в почках половозрелых крыс линии Вистар при моделировании постинфекционного стафилококкового гломерулонефрита Me (Q1 – Q3)
|
Показатель/группа |
Интактные |
1 месяц после инфицирования |
2 месяца после инфицирования |
3 месяца после инфицирования |
|
Количество почечных телец на тестируемой площади |
8(7; 9) |
9(7;9) |
9(8;9) |
8(6;9) |
|
Относительная площадь, занимаемая почечными тельцами на тестируемой площади (в %) |
4,45 (3,85; 5,26) |
3,64 (2,88; 4,20)* р = 0,00016 |
3,85 (2,83; 4,40)* р = 0,002 |
4,25 (3,04; 5,01) |
|
Диаметр почечного тельца (в мкм) |
108,3 (101,2; 115,0) |
90,0 (81,0; 96,5)* р<0,000001 |
99,4 (93,8; 105,8)* р=0,000015 |
109,5 (101,2; 118,1) |
|
Относительная площадь почечного тельца (в %) |
9,82 (8,50; 11,54) |
6,78 (5,67; 8,05)* р<0,000001 |
8,10 (7,34; 8,91)* р<0,000001 |
9,72 (8,35; 11,08) |
|
Диаметр почечного клубочка (в мкм) |
102,7 (97,1; 110,8) |
80,6 (73,6; 87,4)* р<0,000001 |
92,5 (88,2; 97,5)* р<0,000001 |
102,2 (95,2; 108,9) |
|
Относительная площадь почечного клубочка (в %) |
8,00 (7,09; 9,46) |
4,96 (4,05; 6,22)* р<0,000001 |
6,68 (5,67; 7,24)* р<0,000001 |
7,29 (6,48; 8,30)* р=0,004 |
|
Относительная площадь полости капсулы (в %) |
1,01 (0,61; 1,82) |
1,21 (0,81; 1,82) |
1,62 (1,06; 2,02)* р=0,002 |
2,02 (1,62; 2,63)* р<0,000001 |
|
Относительная площадь включений (в %) |
0,00 (0,00; 0,00) |
0,61 (0,20; 0,81)* р<0,000001 |
0,61 (0,40; 0,81)* р<0,000001 |
0,81 (0,61; 1,01)* р<0,000001 |
|
Количество ядросодержащих клеток почечного клубочка |
9,0 (7,0; 10,8) |
4,0 (4,0; 6,0)* р<0,000001 |
11,0 (9,3; 13,0)* р<0,000001 |
10,0 (8,0; 12,0)* р=0,014 |
|
Диаметр капилляров почечного клубочка (в мкм) |
7,13 (6,77; 7,42) |
6,43 (6,07; 6,71)* р<0,000001 |
5,97 (5,70; 6,85)* р<0,000001 |
7,83 (7,13; 8,54)* р=0,00004 |
Примечание: * – достоверные различия представленной группы с группой интактных животных (при р<0,05)
Также обращали на себя внимание резкие изменения со стороны стенки почечных капилляров и их диаметра: количество ядросодержащих клеток почечного клубочка возросло по сравнению с предыдущим сроком в 2,75 раза, что могло свидетельствовать не столько об инфильтрации, сколько о пролиферативном процессе, затрагивающем эндотелий почечных капилляров, и, возможно, мезангиальные клетки. Необходимо отметить, что через 2 месяца после инфицирования уменьшение диаметра капилляров, наблюдаемое на предыдущем сроке, не только продолжало сохраняться, но и стало еще более выраженным (р=0,005) (табл. 1).
Несмотря на имеющиеся изменения со стороны клубочкового аппарата, почечные тельца на данном сроке эксперимента не подвергались редукции и их количество на тестируемой площади достоверно не отличалось от количества почечных телец коркового слоя почек у интактных животных (р=0,121), что свидетельствовало об отсутствии необратимой деструкции почечных телец. Вместе с тем, наблюдалось сморщивание почечных телец, подтверждаемое достоверным уменьшением их диаметра (р=0,000015), а относительная площадь, занимаемая данными структурами, была статистически значимо меньше, чем у группы интактных животных (р=0,002).
Гистологическое изучение образцов ткани большеберцовой кости позволило установить, что через 3 месяца после инфицирования животных 209 штаммом S. aureus сохраняются все морфологические признаки, характерные для остеомиелита.
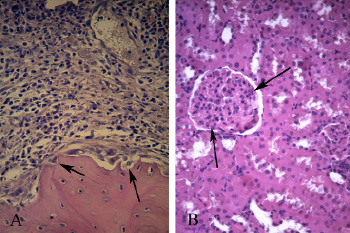
Рис. 2. А) Фрагмент большеберцовой кости крысы через 2 месяца после инфицирования S. aureus. В костной ткани, вблизи от макрофагально-фибробластического барьера, определяется большое количество пустых лакун, дегенеративно-измененных и некротизированных остеоцитов (отмечено стрелками). Окраска гематоксилином и эозином. Ув. х400. В) Участок коркового вещества почек через 2 месяца после инокуляции S. aureus. Деформация почечного клубочка. Мезангиальная и эндокапиллярная гиперклеточность (отмечено стрелками). Окраска гематоксилином и эозином. Ув. х400
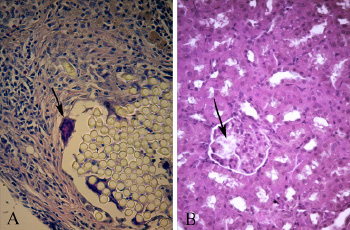
Рис. 3.А) Фрагмент большеберцовой кости крысы через 3 месяца после инфицирования S. aureus. Выраженная реакция макрофагов и фибробластов с формированием соединительнотканной капсулы, отграничивающей нити, введенные в трепанационное отверстие. Гигантская многоядерная клетка Пирогова–Лангханса (отмечено стрелкой). Окраска гематоксилином и эозином. Ув. х400. В) Участок коркового вещества почек через 3 месяца после инокуляции S. aureus. Деформация почечного клубочка. Наличие в просвете капсулы эозинофильного включения (отмечено стрелкой). Дилатация капилляров почечного клубочка. Окраска гематоксилином и эозином. Ув. х400
Так, определялись зоны некроза костной ткани и костного мозга и выраженная лимфоцитарно-макрофагальная инфильтрация в зоне введения нити с суточной культурой золотистого стафилококка, а также присутствовали многоядерные клетки Пирогова–Лангханса (рис. 3А). Отмечались фрагментация, краевая резорбция костных балок, очаги просветления и нарушения тинкториальных свойств костной ткани, замещение клеток костного мозга липоцитами.
В отличие от предыдущих двух сроков, при оценке препаратов почек отмечено, что через 3 месяца после инфицирования отсутствуют лимфоцитарные инфильтраты как в области почечных телец, так и в зоне извитых канальцев, что обусловлено формированием хорошо выраженного макрофагально-фибробластического барьера, способного предотвратить попадание болезнетворных микроорганизмов в кровоток, что исключает явления бактериемии.
В связи с этим на данной стадии развития постинфекционного стафилококкового гломерулонефрита особую роль в поддержании и усилении патологических признаков поражения клубочкового аппарата почек играют изменения цитокинового баланса, возникшие в результате воспалительного процесса в большеберцовой кости. Тот факт, что через 3 месяца после инфицирования S. aureus относительная площадь, занимаемая включениями бесструктурного вещества (скоплений белка, в том числе фибрина, слущенного эпителия), не только не уменьшилась, но и возросла (табл. 1, рис. 3В), свидетельствует о нарастании тяжести патологического процесса, поскольку является отражением увеличения количества белка в первичной моче. Учитывая тот факт, что подобные явления сочетаются с дистрофическими изменениями эпителия проксимальных и особенно дистальных канальцев почек, это может приводить к развитию протеинурии и мочевого синдрома, которые наиболее часто наблюдаются в клинике постинфекционного стафилококкового гломерулонефрита [6].
Необходимо отметить, что, в отличие от предыдущих двух сроков, к 3-му месяцу с момента инфицирования наблюдается резкое увеличение диаметра капилляров почечных клубочков. Так, наблюдалось увеличение этого показателя в 1,3 раза по сравнению со сроком 2 месяца с момента инфицирования, и это статистически значимо более высокий показатель, чем у интактных животных (р=0,005) (табл. 1). Это может свидетельствовать об изменении механизмов ультрафильтрации, которые на этом сроке связаны не столько с гидростатическим давлением в капиллярах почечного клубочка, сколько с повышением онкотического давления в просвете капсулы, что подтверждается дальнейшим увеличением площади, занимаемой включениями, и может быть связано с повреждением базальной мембраны [15]. Не исключено, что данное повреждение обусловлено тем, что стафилококковые энтеротоксины С, А и токсин синдрома токсического шока 1, являясь суперантигенами, играют важную роль в заболевании, поскольку они являются факторами, которые не только стимулируют высвобождение цитокинов иммунокомпетентными клетками, но и способствуют секреции матриксных металлопротеиназ, которые способны оказывать повреждающее действие на базальные мембраны [2, 6, 15].
Согласно литературным данным, наиболее частыми микроскопическими признаками постинфекционного стафилококкового гломерулонефрита являются: 1) протеинурия, наблюдаемая в 98,4% случаев, 2) гематурия – у 91,4% больных, 3) мезангиальная пролиферация – у 64,1% пациентов, 4) эндокапиллярная пролиферация – в 58,6% случаев при данной патологии [6]. В соответствии с этим, для оценки адекватности соответствия полученной модели клиническим наблюдениям решено было использовать два критерия: 1) наличие белковых включений в просвете капсулы, содержащих слущенный эпителий и форменные элементы (как косвенное подтверждение совокупности 1-го и 2-го факторов); 2) показатель мезангиальной и/или эндокапиллярной гиперклеточности (как совместная характеристика 3-го и 4-го фактора). Учитывая, что при микроскопическом анализе препаратов почек, особенно на раннем сроке эксперимента, было выявлено наличие лимфоцитарных инфильтратов как косвенное подтверждение имевшей место бактериемии, этот показатель тоже расценивался как проявление постинфекционного стафилококкового гломерулонефрита. Данные сравнения этих показателей у групп экспериментальных животных представлены в таблице 2.
Полученные данные, отражающие наличие критериев, свидетельствующих о развитии признаков постинфекционного стафилококкового гломерулонефрита при рассматриваемом способе моделирования, характеризуют высокую степень воспроизводимости данной патологии. Так, наличие сочетания не менее двух критериев, свидетельствующих о развитии постинфекционного стафилококкового гломерулонефрита на момент вывода из эксперимента, было отмечено у 14 животных, то есть в 77,8% случаев.
Таблица 2
Количество экспериментальных животных с наличием критериев, подтверждающих развитие постинфекционного стафилококкового гломерулонефрита
|
Критерий/ группа |
Интактные |
1 месяц после инфицирования |
2 месяца после инфицирования |
3 месяца после инфицирования |
|
«+» |
«+» |
«+» |
«+» |
|
|
Белковые включения, содержащие слущенный эпителий и форменные элементы |
0 |
6* р=0,001 |
6* р=0,001 |
6* р0,001 |
|
Мезангиальная и/или эндокапиллярная гиперклеточность |
0 |
0 |
5* р=0,005 |
5* р=0,005 |
|
Наличие лимфоцитарных инфильтратов |
0 |
3 |
1 |
0 |
|
Наличие 2 и более из указанных выше критериев |
0 |
3 |
6* р=0,001 |
5* р=0,005 |
Примечание: * – достоверные различия представленной группы с группой интактных животных (при р<0,05)
Достаточно примечательным является тот факт, что постинфекционный стафилококковый гломерулонефрит можно считать окончательно сформированным ко 2-му месяцу после инокуляции S. aureus. На более раннем сроке исследования преобладают признаки, свидетельствующие, в большей степени, о наличии бактериемии. Согласно литературным данным, продолжительность времени от заражения до начала заболевания в клинической практике варьирует в диапазоне от 2 до 140 дней (в среднем составляя 28,2 дня) [6]. В связи с этим более продолжительный процесс формирования постинфекционного стафилококкового гломерулонефрита (до 2 месяцев) при предлагаемом способе моделирования является несомненным преимуществом, поскольку дает возможность более детально исследовать все стадии развития заболевания, что позволит выявить и более полно охарактеризовать разнообразные звенья патогенеза рассматриваемой патологии.
Выводы
Проведенное исследование позволило установить, что наблюдаемые изменения в большеберцовой кости, обусловленные механическим повреждением, введением инородного тела и инокуляцией 209 штамма S. aureus, характеризуются развитием хронического стафилококкового остеомиелита. При этом формируется участок некроза костной ткани и костного мозга, ограниченный большими скоплениями лимфоцитов и макрофагов с присутствием гигантских клеток Пирогова–Лангханса. К 3-му месяцу с момента инфицирования образуется хорошо выраженная соединительнотканная капсула, надежно предотвращающая дальнейшее развитие бактериемии. Данное состояние сопровождается развитием у экспериментальных животных постинфекционного стафилококкового гломерулонефрита.
Структурные изменения в клубочковом аппарате почек при развитии постинфекционного стафилококкового гломерулонефрита отражают, в первую очередь, нарушение процессов образования первичной мочи. Учитывая, что нарушения ультрафильтрации происходят на фоне дистрофических изменений со стороны эпителиальных клеток проксимальных и особенно дистальных канальцев почек, это может сопровождаться выраженной протеинурией. На основании полученных данных можно предположить, что процессы ультрафильтрации, а следовательно, и основные механизмы образования первичной мочи на разных этапах развития постинфекционного стафилококкового гломерулонефрита являются различными. На первой стадии весьма существенную роль могут играть сморщивание и слущивание эндотелиальных клеток клубочковых капилляров (ранние сроки эксперимента: 1 месяц), позволяющие молекулам белка более легко проникать сквозь оголенную базальную мембрану. Другим и более продолжительным (1–2 месяца) процессом, оказывающим усиливающее влияние на клубочковую фильтрацию, является изменение разницы давлений, обусловленное спазмом отводящей артериолы, и имеющее, по всей вероятности, рефлекторный механизм, что может характеризовать вторую стадию развития постинфекционного стафилококкового гломерулонефрита. В последующем, на третьей стадии (через 3 месяца с момента инфицирования S. aureus), нарастающее увеличение количества белковых комплексов в первичной моче может быть связано уже с повреждением базальной мембраны, поскольку имеется более свободный доступ к ней иммунных комплексов и матричных металлопротеиназ.
Полученные данные, отражающие наличие критериев, свидетельствующих о развитии признаков постинфекционного стафилококкового гломерулонефрита при рассматриваемом способе моделирования, характеризуют высокую степень воспроизводимости данной патологии. Так, наличие сочетания не менее двух критериев, свидетельствующих о развитии постинфекционного стафилококкового гломерулонефрита на момент вывода из эксперимента, было отмечено у 14 животных, то есть в 77,8% случаев.
Более продолжительный процесс формирования постинфекционного стафилококкового гломерулонефрита (до 2 месяцев) при предлагаемом способе моделирования является несомненным преимуществом, поскольку дает возможность более детально исследовать все стадии развития заболевания, что позволит выявить и более полно охарактеризовать разнообразные звенья патогенеза рассматриваемой патологии.
Вполне вероятно, что постинфекционный стафилококковый гломерулонефрит является частным случаем проявления синдрома сочетанных дистрофически дегенеративных изменений мезенхимальных производных при локальном хроническом воспалительном процессе. В этом случае не исключено, что патогенетические механизмы развития данного варианта гломерулонефрита могут отличаться от уже известных.
Таким образом, предлагаемый способ экспериментального моделирования можно рекомендовать для более детального изучения патогенеза заболевания, что необходимо для оптимизации существующих и разработки новых методов лечения и профилактики постинфекционного стафилококкового гломерулонефрита – заболевания, приобретающего в последние годы в развитых странах все больший размах.

