Известно, что поджелудочная железа является уникальным органом, выполняющим ряд важных функций: вырабатывает специальные ферменты для переваривания пищи и производит инсулин, снижающий уровень глюкозы в крови. Нарушение работы поджелудочной железы приводит к сбою функционирования важных органов и различным заболеваниям, а именно к нарушению желудочно-кишечного тракта, развитию панкреатита, сахарного диабета и ряда сопутствующих заболеваний [1].
На сегодняшний день имеется представление о том, что регулярное употребление алкоголя приводит к формированию токсического панкреатита, сопровождающегося внутриорганной патологией. Но природа повреждающего фактора и взаимосвязь органных нарушений в патогенезе формирования токсического панкреатита окончательно не выяснены [2].
По этой причине не всегда возможно применить исключительно терапевтическое лечение и приходится проводить хирургические вмешательства [3].
В связи с этим актуальным является воспроизведение токсического панкреатита, развитого на фоне гиперлипидемии и алкоголизации, что, как правило, в жизни приводит к патологии поджелудочной железы. Выполнение этой задачи позволит уточнить патогенез заболевания, детально проанализировать механизмы формирования и развития патологического процесса как на тканевом, так и на клеточном уровне, а в дальнейшем поможет разрабатывать патогенетически обоснованные методы профилактики и лечения этого заболевания.
Из данных литературы известны несколько способов развития панкреатита у крыс путем моделирования [4; 5].
Один из способов, апробированный на крысах линии Wistar, включает создание гипертензии в биопанкреатическом протоке, за счет сужения просвета в 1,5 раза. Сужение и стенозирование обеспечивали с помощью внешнего сдавливания обернутым вокруг протока и фиксированным к нему лоскутом из вытянутого политетрафторэтилена [4]. Авторы установили, что морфологические признаки у животных появились на 1-е сутки после вмешательства острого панкреатита, а на 90-е сутки – хронического панкреатита. К недостаткам данного способа можно отнести необходимость хирургического вмешательства и то, что данный вид модели не имеет естественных патологических факторов, способствующих развитию панкреатита.
Другой способ, предложенный авторами [5], заключается в создании модели токсического панкреатита путем деструкции ткани поджелудочной железы крыс единичным введением 1%-го раствора тритона Х-100 в объеме 0,1 мл, с последующей алкоголизацией животных в течение трех месяцев 15%-м водным раствором этанола, используемым для питья вместо воды. Но недостатком данного метода является введение животным химического вещества тритона Х-100, используемого для разрушения эукариотических клеток, что является не естественным в жизни человека и вызывает падеж экспериментальных животных.
Цель исследования – воспроизвести модель токсического панкреатита на крысах путем моделирования дислипидемии и принудительной алкоголизации.
Материалы и методы исследования
В проводимом авторами статьи эксперименте использовали беспородных крыс-самцов 12 месяцев (вес 300-350 г). В процессе эксперимента животные были разделены на 2 группы: в первую группу входили интактные животные (контрольная) – 30 животных, которых кормили натуральными и брикетированными кормами в соответствии с нормами, утверждёнными Приказом № 755 от 12.08.77 (Приказ Минздравсоцразвития РФ от 23.08.2010 № 708н «Об утверждении Правил лабораторной практики»); у крыс второй группы – 35 животных (экспериментальная группа), индуцировали токсический панкреатит. Для этого животных содержали на высокожировом рационе в течение трех месяцев, развивая дислипидемию, а после достижения целевого уровня холестерина, равного 3,83±0,31 ммоль/л (контроль 2,2±0,2 ммоль/л) [6], каждые 24 часа принудительно внутрижелудочным методом вводили 20%-й спиртовой раствор в расчете 3 мл/кг через пищевой зонд в течение двух месяцев.
По окончании эксперимента животных декапитировали под эфирным наркозом. Все манипуляции выполнялись в соответствии с «Общими этическими принципами экспериментов над животными», утверждённым І Национальным конгрессом по биоэтике. Забор биоматериала для биохимического и морфологического исследования проводили в соответствии с «Международными рекомендациями по проведению медико-биологических исследований с использованием животных», «Правилами проведения работ с использованием экспериментальных животных» и «Правилами лабораторной практики в Российской Федерации» (Приказ МЗ РФ № 267 от 19.06.2003).
Для проведения биохимического анализа готовили гомогенаты ткани печени и поджелудочной железы в соотношении 1 часть ткани к 9 частям охлажденного физиологического раствора, центрифугировали при 3000 об./мин.
В гомогенатах определяли концентрацию лактата, пировиноградной кислоты (ПВК) и восстановленного глутатиона (GSH), а также активность ферментов: глутатионпероксидазы (ГПО) и глутатионредуктазы (ГР) [7].
В сыворотке крови определяли уровень амилазы, общего белка, щелочной фосфатазы, глюкозы и общего холестерина после 12 ч голодания из хвостовой вены крыс (0,3-0,7 мл).
Статистическая обработка проводилась с использованием пакета прикладной программы Statistica, версия 10.0, и Microsoft Office Excel Worksheet. После проверки распределения на нормальность о достоверности отличий учитываемых показателей сравниваемых групп судили по величине t-критерия Стьюдента, при ненормальности распределения – U-критерия Манна – Уитни. Статистически достоверными считали отличия, соответствующие оценке ошибки вероятности р ≤ 0,05.
Результаты исследования и их обсуждение
Известно, что баланс уровня восстановленного и окисленного глутатиона в клетках контролируется отношением ферментов ГР и ГПО, что свидетельствует об антиоксидантной защите клетки и состоянии адаптивно-компенсаторных изменений [8].
Результаты биохимических изменений, полученные при анализе ткани поджелудочной железы, отражены в таблице 1.
Анализ показателей углеводного обмена в гомогенате поджелудочной железы у экспериментальных животных (группа 2) указывал на существенное увеличение уровня лактата на 128,57% (p<0,001) и ПВК на 161,54% (p<0,001) относительно данных контрольной группы, что свидетельствует об усилении аэробных процессов и формировании тканевой гипоксии.
Результаты определения активности ключевых ферментов глутатионового звена антиоксидантной защиты у группы с токсическим панкреатитом в поджелудочной железе указывают на уменьшение активности ГПО на 36,17% (p<0,001) и активности ГР на 53,91% (p<0,001), на фоне тенденции к накоплению концентрации GSH на 28,45% (p>0,05) относительно данных контроля. Полученные результаты свидетельствуют о снижении антиоксидантной защиты. Эти данные отражают снижение возможностей глутатионового звена антиоксидантной защиты, что ведет к накоплению продуктов радикальной природы в панкреоцитах.
Результаты анализа крови, полученные по окончании эксперимента у группы с токсическим панкреатитом, отображены в таблице 2.
У животных с токсическим панкреатитом относительно группы контроля выявлено увеличение активности амилазы на 298% (p<0,001) и глюкозы на 107, 24% (p<0,001), а также снижение концентрации общего белка на 16,04% (p>0,001) и активности щелочной фосфатазы на 7,73% (p>0,05), что указывает на развитие воспалительного процесса в клетках поджелудочной железы.
Для выявления морфофункциональных сдвигов проведено исследование в патологоанатомическом бюро ГБУ РО «ПАБ» кусочков ткани поджелудочной железы и печени экспериментальных крыс. Парафиновые срезы фиксировались в 10%-м растворе нейтрального формалина и окрашивались гематоксилином-эозином.
Морфологически в ткани поджелудочной железы выявлена атрофия железистой паренхимы (1) и островков Лангерганса (2), выраженный перидуктальный меж- и внутридольковый липоматоз (3) (рисунок).
Таблица 1
Состояние ключевых показателей углеводного и глутатионового обмена в ткани поджелудочной железы у животных с токсическим панкреатитом
|
Группы Показатели |
Группа 1, n=30 (контрольная группа) |
Группа 2, n=35 (токсический панкреатит) |
|
ПВК, мкмоль/мг белка |
0,39±0,04 |
1,2±0,09*, p<0,001 |
|
Лактат, мкмоль/мг белка |
3,15±0,29 |
7,2±0,69*, p<0,001 |
|
GSH, мкмоль/мг белка |
49,94±5,1 |
64,15±6,6, p>0,05 |
|
ГПО, мкмоль/мг белка |
16,2±1,5 |
10,34±1,1*, p<0,001 |
|
ГР, мкмоль/мг белка |
1,28±0,13 |
0,59±0,06*, p<0,001 |
Таблица 2
Биохимические изменения показателей крови у животных с токсическим панкреатитом
|
Группа Показатель |
Группа 1, n=30 (контрольная группа) |
Группа 2, n=35 (токсический панкреатит) |
|
Амилаза, Е/л |
628,21±18,67 |
2502,33±130,77*, p<0,001 |
|
Общий белок, г/л |
102,55±3,29 |
86,1±3,79*, p>0,001 |
|
Щелочная фосфатаза, Е/л |
1145,78±45,96 |
134,51±8,46, p>0,05 |
|
Глюкоза, ммоль/л |
3,04±0,28 |
6,3±0,48*, p<0,001 |
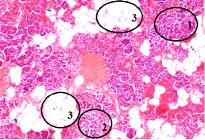
Ткань поджелудочной железы (х 100). На снимке изображена ткань поджелудочной железы у испытуемого животного № 6 из группы с токсическим панкреатитом
Полученные результаты морфологического исследования доказывают наличие моделируемого заболевания и согласуются с данными, приведенными в литературе [9].
Заключение
Таким образом, полученные данные проведенного анализа показали, что представленный способ моделирования у животных токсического панкреатита приводит к нарушению в ткани поджелудочной железы ключевых звеньев метаболических процессов (углеводного и глутатионового обмена) и морфологических изменений, доказывающих данную патологию.
В отличие от приведенных в литературных источниках методов моделирования панкреатита, предложенный авторами данной статьи способ в эксперименте не требует хирургических манипуляций и введения химических веществ, не естественных в жизни человека, кроме этого, прост в исполнении и не вызывает падежа животных. В связи с этим представленный метод воспроизведения токсического панкреатита у крыс в экспериментальных исследованиях позволяет не только уточнить сложные механизмы развития патологического процесса и структурно-функциональные нарушения в поджелудочной железе, но и может быть использован для составления схем коррекции, направленных на снижение патобиохимических изменений, происходящих в желудочно-кишечном тракте при токсическом панкреатите.

