Всемирная организация здравоохранения (ВОЗ) рекомендует рассматривать ожирение как неинфекционную эпидемию XXI века. Анализ литературных данных показал, что само ожирение нередко рассматривается как заболевание, к которому приводит комплекс позиций, таких как предпочтения в режиме питания, жизненные привычки, генетически обусловленная предрасположенность [1]. Также ряд авторов отмечают, что гипотиреоз, сопровождающий ожирение, вносит свой вклад в состояние системы гемостаза пациентов [2]. Специалисты ВОЗ полагают, что к 2025 г. число лиц с ожирением в мире может достичь порядка 300 млн. Также авторы отмечают, что ожирение у пациентов нередко приводит к падению качества жизни на фоне выявления ряда сопутствующих заболеваний и риску развития инвалидности [3, 4]. ВОЗ трактует ожирение как неинфекционную эпидемию XXI века. В наши дни распространенность ожирения нарастает во всех возрастных группах населения. Так, свыше 1,4 млрд взрослых и детей имеют повышенный индекс массы тела, из них порядка 500 млн человек страдают ожирением. В России распространенность ожирения среди взрослого населения составляет около 37%. Среди детей и подростков (за последние 20 лет) доля страдающих этим недугом в возрастной группе 6–11-летних увеличилась с 7 до 13%, в группе 12–19-летних возросла с 5 до 14%, ожирение выявлено у 5,5% сельских и 8,5% городских детей. Как известно, ожирение приводит не только к снижению общей продолжительности жизни, но и к инвалидности людей, в том числе в молодом возрасте. Набор массы тела пациентами при ожирении сопровождается, как указывают авторы, такими состояниями, как ИБС, гипертония, сахарный диабет 2-го типа [5]. Ожирение часто протекает на фоне гипотиреоза различной этиологии. При этом, как следует из данных литературы, ожирение в сочетании с АГ нередко приводит к риску образования тромбов в сосудах жизненно важных органов человека – сердца и мозга, увеличивая возможность возникновения инфаркта миокарда или инсульта. Следовательно, изучение таких сочетанных состояний представляется авторам актуальной научной задачей.
Цель исследования – оценить динамику изменения клинического анализа крови, гемостаза, липидограммы, состояние электролитов у пациентов с артериальной гипертензией (АГ) и ожирением на фоне разгрузочно-диетической терапии (РДТ).
Материалы и методы исследования
В исследовании приняли участие 50 человек (13 мужчин и 37 женщин) в возрасте от 18 до 62 лет. Пациенты, участвующие в обследовании, были разделены на группы: с ожирением I–III степени абдоминального типа и АГ I–III степени по гипертоническому типу. У пациентов по ходу обследования выявлялся гипотиреоз. В группу контроля вошли 23 здоровых донора, не имеющих нарушений и сочетанных патологий в изучаемой группе. Курс РДТ проводился по методике, разработанной Минздравсоцразвития РФ [6]. Биохимические показатели крови и гемостаза были определены на биохимическом анализаторе «Сапфир-400» (Япония). Все пациенты получали соответствующую показаниям медикаментозную терапию. Для определения достоверности отличий вычисляли доверительный коэффициент Стьюдента (t) и величину вероятности (р).
Результаты исследования и их обсуждение
Исследования показали, что у пациентов в изучаемых группах просматривалась позитивная динамика до и после курса РДТ. В ходе исследования у пациентов было отмечено достоверное снижение как индекса массы тела, так и показателей систолического и диастолического артериального давления. Эти данные приведены на рисунке 1.
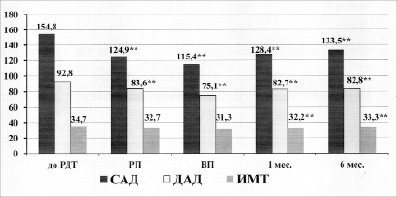
Рис. 1. Изменение ИМТ, АД у пациентов с ожирением и артериальной гипертензией до и после курса РДТ: РДТ – разгрузочно-диетическая терапия, РП – разгрузочный период, ВП – восстановительный период, ИМТ – индекс массы тела, САД – систолическое артериальное давление, ДАД – диастолическое артериальное давление, * – достоверные отличия р<0,05, ** – достоверные отличия p<0,01
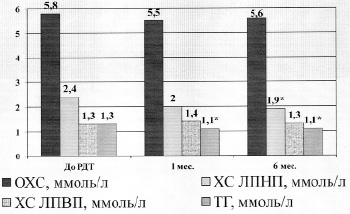
Рис. 2. Изменение уровня липидов плазмы у пациентов с ожирением и артериальной гипертензией до и после курса РДТ: РДТ – разгрузочно-диетическая терапия, ОХС – общий холестерол, ХС ЛПНП – холестерол липопротеидов низкой плотности, ХС ЛПВП – холестерол липопротеидов высокой плотности, ТГ – триглицериды, * – достоверные отличия р<0,05
Ряд авторов отмечают, что ожирение у некоторых пациентов сопровождается повышением таких показателей липидного обмена, как ТГ, ХС, ЛПНП. И это достоверные данные [1, 7]. Биохимические исследования липидного спектра плазмы крови пациентов отражены на рисунке 2.
Как видно из рисунка 2, у пациентов в изучаемых группах в сравнении с исследованиями до РДТ и спустя 1 и 6 месяцев после лечебных мероприятий выявлено достоверное снижение уровня ТГ и холестерола в составе липопротеидов низкой плотности (ХС ЛПНП). При этом содержание общего холестерола, в том числе в составе ЛПВП, оставалось примерно на одном уровне. И, поскольку, как известно, ЛПВП являются системами вывода избыточного холестерола из организма (антиатерогенные частицы), то здесь явно просматривается тенденция к выравниванию соотношения ЛПНП/ЛПВП в сторону антиатерогенных. По данным исследования, снижение ТГ, ХС и ЛПНП в плазме составил 15,4%, 3,4% и 20,8% соответственно. Эти показатели на фоне РДТ в целом положительно сказываются на состоянии пациентов во всех исследуемых группах, что соотносится с данными литературных источников и является благоприятным прогностическим фактором повышения качества жизни пациентов.
По мнению ряда авторов, рост объемов абдоминального жира нередко граничит с тромбозами. У таких пациентов отмечается рост значений таких показателей, как ф.VII (проконвертин), ф.I (фибриноген) и ингибитор активатора плазминогена. Таким образом, активация у таких пациентов системы свертывания крови, приводящая к формированию тромбов, торможению процессов фибринолиза, повышает и риск развития сердечно-сосудистых заболеваний за счет тромбообразования [8]. Запуск внутрисосудистой активации тромбоцитов у таких пациентов держит в напряжении систему первичного гемостаза [9]. Исследования показателей гемостаза у пациентов: количества тромбоцитов, отвечающих за первичный гемостаз, активированного частичного тромбопластинового времени (АЧТВ) и протромбинового индекса (ПТИ), характеризующих соответственно состояние внутреннего и внешнего путей коагуляционного гемостаза, позволили выявить следующее. После курса РДТ у пациентов отмечалось удлинение АЧТВ (38,52±3,0*) и ПТИ (99,25±4,5*) против контрольных значений 30,71±3,5 и 91,35±3,5 соответственно (р<0,01). Показатели отражали достоверные тенденции к изменению, по сравнению с контрольной группой увеличились на 25,4% (АЧТВ) и 8,7% (ПТИ).
Высокие показатели липидного спектра плазмы крови (ХС, ЛПНП) способны стимулировать как агрегацию тромбоцитов, так и реактивность некоторых клеток крови (эритроцитов) и в литературе указывается на существующую между ними зависимость [10, 11].
Таблица 1
Показатели клинического анализа крови пациентов в изучаемых группах
|
Показатели |
Контроль |
Пациенты с АГ + АО |
Пациенты с АГ без АО |
|
Эритроциты, 1012/л |
4,66 ± 1,1 |
4,84 ± 1,3 |
4,76 ± 0,7 |
|
Тромбоциты, 109/л |
297,17 ± 3,5 |
228,17 ± 4,2* |
190,25 ± 7,7* |
|
Лейкоциты, 109/л |
5,99 ± 1,3 |
6,33 ± 1,5 |
4,72 ± 5,3* |
|
Лимфоциты, % |
27,58 ± 3,5 |
35,33 ± 5,2* |
39,75 ± 3,3* |
|
Моноциты, % |
5,9 ± 1,5 |
4,58 ± 1,7 |
5,5 ± 2,1 |
Примечание: АГ+АО – артериальная гипертензия + абдоминальное ожирение, АГ без АО – артериальная гипертензия без абдоминального ожирения, * – достоверные отличия от значений контроля р<0,01.
В то же время есть упоминание о том, что ожирение способно запускать процессы перекисного окисления липидов (ПОЛ) как в гепатоцитах, так и лейкоцитах, причем у последних в этом случае отмечается рост продукции активных формы кислорода [12]. Форменные элементы крови, такие как эритроциты, лейкоциты, тромбоциты, как отмечают ряд авторов, способны участвовать в первичном гемостазе [11], и процессы ПОЛ активно этому способствуют [13]. Исследование клинического анализа плазмы крови пациентов в изучаемых группах приведено в таблице 1.
Как видно из таблицы 1, у пациентов в изучаемых группах в сравнении с группой контроля отмечаются достоверное падение числа тромбоцитов, достоверное повышение уровня лимфоцитов. Полученные данные согласуются с литературными данными. Так, падение числа тромбоцитов показывает, что в этих клетках, вероятно, запускаются процесс агрегации и выброс в кровоток активных тромбоцитарных факторов, а также возникает склонность системы гемостаза пациентов к гипокоагулемии (риск формирования тромбоцитарной пробки). Все перечисленное говорит об активации роста скорости непрерывного внутрисосудистого свертывания крови (НВСК), где тромбоциты играют ведущую роль, и повышении напряжения в системе гемостаза [11, с. 24].
Известно, что активные формы кислорода (АФК), такие как радикал супероксид аниона и перекись водорода, продуцируются пероксисомами лейкоцитов. В наших исследованиях авторы получили достоверный рост лимфоцитов в изучаемых группах. В некоторых литературных источниках отмечено, что продукция АФК способна повышаться как на фоне ожирения, так и при РДТ [12], когда лейкоциты (лимфоциты, моноциты, нейтрофилы) начинают наращивать продукцию АФК [11, с. 9]. Активация и рост таких процессов пероксидации затрагивают мембраны клеток крови пациентов в изучаемых группах, а продукты ПОЛ, продуцируемые клетками «белого ряда», запускают активацию тромбоцитов [13]. Показатели эритроцитов и моноцитов как активных участников этих процессов носили недостоверный характер. Уровень изменения количества форменных элементов крови после курса РДТ был недостоверным и разнонаправленным в большинстве фракций, за исключением лимфоцитов. У пациентов как в группе с АГ + АО, так и в группе с АГ без АО после курса РДТ отмечалось достоверное падение уровня лимфоцитов 17,05±4,4* и 19,85±4,9* (р<0,01) соответственно, что указывает на их разрушение. И это соотносится с данными литературы. Голодание в ходе РДТ способствует увеличению числа лимфоцитов, погибающих за счет активации процессов апоптоза этих клеток и снижения антиоксидантной защиты организма [12].
В ряде литературных источников указано, что гипотиреоз, провоцирующий у пациентов состояние ожирения, вносит свой вклад в разбалансировку системы гемостаза [14]. Следует отметить, что гипотиреоз выявлялся у пациентов как сопутствующее заболевание в ходе обследования в изучаемых группах. Анализ полученных нами результатов: удлинение АЧТВ, ПТИ, снижение числа тромбоцитов после курса РДТ во всех группах исследования – позволяет предположить, что система свертывания крови пациентов находится в состоянии напряжения и, возможно, начальной стадии гипокоагулемии потребления на фоне внутрисосудистой активации тромбоцитов. Это подтверждается и данными литературных источников [15, 14].
На следующем этапе исследований авторы уделили внимание вопросу ионного баланса при РДТ.
Таблица 2
Показатели ионного состава плазмы крови пациентов, в изучаемых группах
|
Ионы плазмы ммоль/л |
Пациенты до РДТ |
Пациенты через 1 месяц после РДТ |
Пациенты через 6 месяцев после РДТ |
||||||
|
Контроль |
АГ без АО |
АГ + АО |
Контроль |
АГ без АО |
АГ + АО |
Контроль |
АГ без АО |
АГ + АО |
|
|
Na+ |
142,91±1,19 |
141,71±1,14 |
141,79±1,15 |
143,35±0,69 |
141,61±0,80* |
141,91±0,68* |
143,48±0,67 |
142,39±0,67 |
143,70±1,01 |
|
K+ |
4,48±0,13 |
4,53±0,11 |
4,47±0,09 |
4,37±0,13 |
4,51±0,10 |
4,38±0,11 |
4,32±0,09 |
4,36±0,11 |
4,41±0,10 |
|
Cl- |
98,87±1,72 |
100,61±1,29 |
99,33±1,19 |
100,30±1,37 |
100,43±0,67 |
99,42±0,96 |
101,04±0,74 |
100,21±0,94 |
100,76±1,14 |
Примечание: РДТ – разгрузочно-диетическая терапия, АГ без АО – артериальная гипертензия без абдоминального ожирения, АГ+АО – артериальная гипертензия + абдоминальное ожирение, * – достоверные отличия от значений контроля р<0,05
Известно, что система разгрузочной терапии способна запустить у пациентов ряд биохимических процессов, которые стимулируют: извлечение липидов из жировых депо (липолиз), синтез кетоновых тел (кетогенез), активный распад белков с повышением образования мочевины и пр. Все вышеперечисленное требует выведения вышеназванных соединений из организма. В эту работу включаются и почки, и другие системы выделения, что согласуется с данными литературы [16]. Ряд авторов отмечают, что у пациентов набор массы тела при ожирении происходит на фоне роста в кровотоке уровня альдостерона, задержки ионов натрия и активации ренин-ангиотензиновой системы [8, 17, 18]. Важно отметить, что повышенный уровень ангиотензина II (Анг II) как компонента РАС возникает, прежде всего, из-за излишней массы жировой ткани, которая приводит к повышению АД. В исследуемых группах были изучены показатели ионного состава плазмы крови: Na+, K+, Cl- – до РДТ и спустя 1 и 6 месяцев как основных участников системы РАС. Результаты представлены в таблице 2.
Как видно из таблицы 2, через 1 месяц после РДТ произошло достоверное снижение у пациентов в изучаемых группах уровня Na+ как внеклеточного иона в плазме по сравнению с контролем. Эти данные соотносятся и с показателями АД, и снижением ИМТ пациентов, которые наиболее ярко себя проявили именно на этом этапе исследования. К тому же напомним, что этот ион является еще и компонентом щелочных резервов организма. При запуске процессов тканевого липолиза во время курса РДТ неизменно будет запускаться синтез кетоновых тел, что нередко приводит к состояниям метаболического ацидоза и высоким потреблением буферных систем, как клетки, так и плазмы крови, а также ионов Na+ как одного из ведущих участников щелочных резервов организма. Через 6 месяцев, как видно из таблицы 2, уровень ионов Na+ у пациентов восстанавливается. Динамика изменений уровня ионов K+ и Cl- минимальна и носит недостоверный характер.
Заключение
У пациентов в изучаемых группах: с ожирением I–III степени абдоминального типа и АГ I–III степени по гипертоническому типу – до и после курса РДТ отмечалось достоверное снижение ИМТ, САД и ДАД. Лечебная терапия, запустив липолиз жировой ткани, позволила выявить падение уровня ТГ и холестерола в составе липопротеидов низкой плотности и нормализовать соотношение ЛПНП/ЛПВП в сторону антиатерогенных.
Анализ показателей коагулограммы дал возможность установить, что удлинение АЧТВ, ПТИ, снижение числа тромбоцитов, лимфоцитов после курса РДТ во всех группах исследования указывают на активацию роста скорости НВСК, процессов ПОЛ в клетках форменных элементов крови. Все вышеперечисленное позволяет полагать, что система свертывания крови пациентов находится в состоянии напряжения. На фоне внутрисосудистой активации тромбоцитов у пациентов вначале запускается коагуляционный гемостаз. Причем гиперкоагуляция и нарушения системы фибринолиза, как отмечается и в литературных источниках, прямо взаимосвязаны с повышением массы тела. Далее система гемокоагуляции переходит в начальную стадию гипокоагулемии потребления. Рост АФК в лейкоцитах и стимуляция в последующем этих процессов в тромбоцитах и эритроцитах вызывают падение их количества и снижают тем самым антиоксидантную защиту человека.
У пациентов с ожирением просматривается связь между ростом показателей артериального давления и ангиотензиногеном как одним из участников регуляции водно-солевого обмена. При ожирении у пациентов повышается реабсорбция натрия в дистальных канальцах нефрона. В ответ на это компенсаторно повышается и артериальное давление, что соотносится с данными литературы. Курс РДТ запускает тканевой липолиз, что стимулирует синтез кетоновых тел, приводит к развитию метаболического ацидоза, и высоким потреблением буферных систем, как клетки, так и плазмы крови. При этом будет меняться и уровень ионов Na+ как одного из ведущих участников щелочных резервов организма. Через 6 месяцев уровень ионов Na+ у пациентов восстанавливается, приближаясь к параметрам нормы.

