В настоящее время мировое годовое производство фосфора электротермическим методом составляет ≈1 млн т [1]. В Казахстане ТОО «Казфосфат» ежегодно производит 60–80 тыс. т фосфора. Стабильному развитию фосфорной электротермии в Казахстане в значительной степени способствует наличие двух фосфоритоносных бассейнов: Каратауского и Актюбинского, с балансовыми запасами 483 млн т по Р2О5 [2]. Фосфор из фосфоритов производится в электропечах при температуре 1400–15000С. При электротермическом получении фосфора наряду с основной реакцией:
Ca3(PO4)2 + 5C + 3SiO2 =
= 0,5P4(g) + 3CaSiO3 + 5CO (1)
происходит восстановление железа:
Fе2О3 + 3С = 2Fе + 3СО. (2)
Кроме этой реакции, железо поступает в печь с расходуемой оболочкой самоспекающихся электродов. При этом на 1 т фосфора образуется до 600 кг побочного продукта – феррофосфора, в который переходит основное количество железа (до 80%) и частично (до 4–5%) фосфора. Ранее [3, 4] были приведены результаты исследований переработки фосфоритов с одновременным получением в руднотермической электропечи ферросплава, карбида кальция с извлечением фосфора в возгоны. Основой для процесса является реакция:
Ca3(PO4)2 + SiO2 + 16С + Fe =
= 0,5P4(g) + FeSi + 3СаС2 + 10СО. (3)
Было показано влияние температуры, количества железа и углерода на равновесное распределение кремния в сплав, кальция в карбид и фосфора в газ. Тем не менее, в этих работах не приводится анализ влияния технологических параметров на образование фосфидов железа и степень извлечения фосфора в побочный продукт – феррофосфор.
В фосфоритах также содержится 2–2,3% фтора. Из практики электроплавки фосфоритов при 1400–1500оС с получением фосфора [5, с. 259] известно, что большая часть фтора (93–96%) переходит в шлак. В предлагаемой технологии фосфоритов, с получением ферросилиция и технического карбида (вместо шлака), присутствие фтора в карбиде кальция нежелательно, так как при получении ацетилена по реакции СаС2+Н2О = С2Н2+Са(ОН)2 возможно образование токсичного НF [6, с. 22]. В литературе отсутствует информация о поведении фтора при одновременном получении кремнистого сплава и карбида кальция, от которого во многом зависит экологическая состоятельность разрабатываемого метода.
Цель исследования – определение равновесных термодинамических, технологических параметров, при которых не происходит перехода фосфора в феррофосфор, а фтора – в технический карбид кальция.
В настоящей работе приводятся результаты исследований влияния температуры и количества железа на степень извлечения из смесей фосфоритов фосфора в феррофосфор в виде фосфидов железа, а также по равновесному распределению фтора между конденсированной и газовой фазой.
Материалы и методы исследования
Исследования проводили методом компьютерного термодинамического моделирования системы смесь фосфоритов месторождений Чулактау (Каратау) / Чилисай (Актобе) (2:1)– углерод–железо. Фосфориты содержали, масс. %:
– Чулактау: 51,1 P2O5, 25,8 SiO2, 10,7 CaO, 3,5 CaF2, 2,1 Fe2O3, 2,8 Al2O3, 2,5 MgO;
– Чилисай: 24,0 Са3(PO5)2, 58,8 SiO2, 4,8 CaO, 0,8 CaF2, 3,7 Fe2O3, 2,0 Al2O3, 1,0 MgO. Количество железа изменяли от 17 до 47% от массы фосфорита. А количество углерода было постоянным и составляло 100% от теоретически необходимого для восстановления кремния, железа, фосфора и кальция до СаС2.
Для термодинамического моделирования использовали программный комплекс HSC-10.0 Chemistry, разработанный Outokumpu Research Oy (Финляндия), основанный на минимуме свободной энергии Гиббса [7].
Результаты исследования и их обсуждение
Результаты зависимости равновесной степени распределения фосфора в фосфиды железа от температуры показаны на рисунке 1.
Видно, что в небольшом в температурном интервале 1000–1500оС в системе образуются фосфиды Fе2Р, Fе3Р, FеР, FеР2. Максимум образования фосфидов железа приходится на 1200–1300оС. При температуре более 1500оС фосфиды железа в системе не образуются. Доминирующим фосфидом железа при 32 и 47% Fе является FеР, а при 17% – FеР2 и FеР.
Из рисунка 2 следует, что увеличение в шихте железа от 17 до 47% повышает степень максимального извлечения фосфора в Fе3Р, Fе2Р, FеР. Заметный переход фосфора в FеР2 изменяется незначительно (от 13,06 до 16,20%). В таблице 1 и на рисунке 3 приведена информация о суммарном переходе фосфора в феррофосфор.
Видно, что с повышением количества железа переход фосфора из смесей фосфоритов в феррофосфор возрастает. Максимум этого перехода (67,91%) наблюдается при 1300оС и 47% железа. При температуре более 1500оС фосфиды железа в исследуемой системе не образуются.
На основе рисунка 3, таблицы 2 и по [8] нашли уравнение регрессии влияния температуры и железа на степень перехода фосфора в феррофосфор.
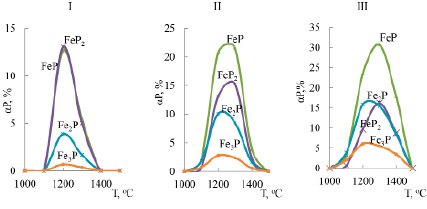
Рис. 1. Влияние температуры и железа на равновесную степень распределения фосфора между фосфидами железа в системе «смесь фосфоритов – углерод – железо»: железо: І – 17%, ІІ – 32%, ІІІ – 47%
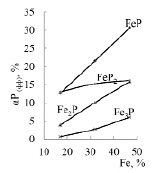
Рис. 2. Влияние железа на максимальную степень извлечения фосфора в фосфиды железа
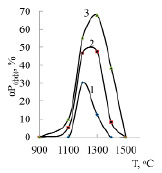
Рис. 3. Влияние температуры и железа на степень извлечения фосфора в феррофосфор: количество железа, %: 1 – 17; 2 – 32; 3 – 47
Таблица 1
Влияние температуры и железа на степень извлечения фосфора в феррофосфор, %
|
Т, оС |
900 |
1100 |
1200 |
1300 |
1400 |
1500 |
1700 |
1900 |
2200 |
|
17%Fе |
0 |
0 |
30,30 |
12,51 |
0 |
0 |
0 |
0 |
0 |
|
32%Fе |
0 |
5,32 |
46,80 |
47,69 |
8,30 |
0 |
0 |
0 |
0 |
|
47%Fе |
0 |
9,93 |
55,23 |
67,92 |
38,54 |
0 |
0 |
0 |
0 |
αР(фф)= –2430,1 + 4,102·Т – 3,52·Fе – 4,62·10-3·Fе2 – 1,65·10-3·Т2 + 3,98·Т·Fе10-3. (4)
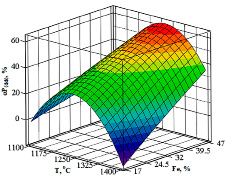
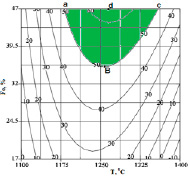
По методикам [8, 9], с использованием уравнения 4, были получены обьемные и плоскостные изображения влияния темпреатуры и железа на степень перехода фосфора в феррофосфор. Из рисунка 4 видно, что значительный (≥50%) переход фосфора в феррофосфор происходит в области abcd (при 1180,6–1358,4оC и 35,6–47% Fе).
Таблица 2
Матрица планирования исследований и их результаты
|
№ |
Переменные |
αР(фф),% |
|||
|
Кодированный вид |
Натуральный вид |
||||
|
Х1 |
Х2 |
Т, 0С |
Fe, % |
||
|
1 |
–1 |
–1 |
1144 |
42,6 |
18,49 |
|
2 |
+1 |
–1 |
1359 |
21,4 |
11,0 |
|
3 |
–1 |
+1 |
1144 |
17,0 |
34,0 |
|
4 |
+1 |
+1 |
1359 |
17,0 |
44,5 |
|
5 |
+1,414 |
0 |
1403 |
32,0 |
9,98 |
|
6 |
–1,414 |
0 |
1099 |
32,0 |
7,91 |
|
7 |
0 |
+1,414 |
1251 |
17,0 |
62,46 |
|
8 |
0 |
–1,414 |
1251 |
46,9 |
27,73 |
|
9 |
0 |
0 |
1251 |
32,0 |
46,14 |
|
10 |
0 |
0 |
1251 |
32,0 |
46,14 |
|
11 |
0 |
0 |
1251 |
32,0 |
46,14 |
|
12 |
0 |
0 |
1251 |
32,0 |
46,14 |
|
13 |
0 |
0 |
1251 |
32,0 |
46,14 |
A Б
Рис. 4. Влияние температуры и железа на степень перехода фосфора в феррофосфор^ А – Объемное изображение, Б – Плоскостное изображение
Таблица 3
Влияние температуры и содержания железа на равновесную степень распределения фтора (%) при взаимодействии смесей фосфоритов с углеродом и железом
|
Т,оС |
17%Fе |
47%Fе |
||||||
|
СаF2 |
СаF2(г) |
СаF(г) |
F(г)* |
СаF2 |
СаF2(г) |
СаF(г) |
F(г)* |
|
|
1300 |
99,98 |
0,019 |
<0,001 |
0,019 |
99,982 |
0,018 |
<0,001 |
0,018 |
|
1500 |
99,428 |
0,565 |
0,007 |
0,572 |
99,413 |
0,579 |
0,003 |
0,587 |
|
1600 |
97,878 |
2,056 |
0,066 |
2,122 |
97,849 |
2,085 |
0,066 |
2,151 |
|
1700 |
91,945 |
7,375 |
0,680 |
2,055 |
91,774 |
7,541 |
0,685 |
8,226 |
|
1800 |
68,632 |
23,488 |
5,880 |
31,368 |
68,175 |
26,012 |
5,813 |
31,825 |
|
1900 |
0,0 |
67,638 |
32,342 |
100,0 |
0,0 |
67,495 |
32,505 |
100,0 |
|
2000 |
0,0 |
42,660 |
57,340 |
100,0 |
0,0 |
40,151 |
59,849 |
100,0 |
* F(г) = ΣСаF2(г) и СаF(г).
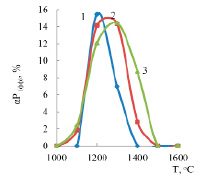
Рис. 5. Влияние температуры и железа на αР(фф) , % Цифры у линий – количество железа, %: 1 – 17; 2 – 32; 3 – 47
На рисунке 5 показано изменение концентрации фосфора в феррофосфоре. Видно, что концентрация этого элемента не превышает 16%. Максимальная концентрация (15,44%) отмечается при 1200оС в присутствии 17% железа.
Видно, что при Т≥1500оС в сплаве фосфор отсутствует. Следовательно, в разработанной технологии образующийся при более высокой температуре (1800–2000оС) ферросплав не будет содержать фосфор.
В таблице 3 показано изменение степени перехода фтора в конденсированный и газообразные фториды кальция.
Из таблицы 3 видно, что конденсированный СаF2 в системе исчезает при Т˃1800оС, а полный переход фтора в газовую фазу в виде ΣСаF2(g) и СаF(g) наблюдается при 1900оС и более высокой температуре. Причем первоначально фтор преимущественно (до 1900оС) переходит в газ в виде СаF2(g), а затем в виде СаF(g). Общая степень перехода фтора в газовую фазу (αF(газ)) в виде ΣСаF2(g) и СаF(g) не зависит от количества железа. Основным фактором при этом является температура. Зависимость αF(газ) = f(Т) имеет вид:
αF(газ) = –13480 + 25,401·Т –
– 0,0159·Т2 + 3,310-6·Т3. (5)
Имея в виду, что совместное одновременное получение кремнистого сплава, карбида кальция и отгонка фосфора из смеси фосфоритов происходят при 1900–2000оС, можно предположить, что фтор при этом не будет концентрироваться в техническом карбиде кальция, а будет переходить в газ совместно с фосфором. Затем фтор будет осаждаться с котрельной пылью в электрофильтрах.
Выводы
На основании полученных результатов по равновесному распределению фосфора в феррофосфор и фтора между конденсированной и газовой фазой можно заключить, что:
– фосфиды фосфора FеР2, FеР, Fе2Р и Fе3Р образуются в температурном интервале 1000–1500оС;
– увеличение в системе содержания железа от 17 до 47% приводит к заметному повышению максимального перехода фосфора в Fе3Р, Fе2Р, FеР и незначительному – в FеР2; преобладающим фосфидом, в который переходит фосфор, является FеР;
– значительная (≥50%) степень перехода фосфора в феррофосфор наблюдается при 1180,6–1358,6оС и 35,6–47% Fе;
– при температуре 1800–2000оС, когда в системе формируется карбид кальция, не следует ожидать получения кремнистого ферросплава, содержащего фосфор; фтор в этой температурной области будет полностью переходить в газ в виде СаF2, СаF и не будет загрязнять карбид кальция.

