Герпес-вирусные инфекции широко распространены в популяции человека и имеют разнообразные клинические проявления, включая скрытое бессимптомное течение [1, с. 330]. По данным ВОЗ, вирусами герпеса инфицировано 65–90% населения планеты [2; 3]. Для человека патогенны 8 типов вируса герпеса: вирусы герпеса 1 и 2 типа, вирус ветряной оспы (3 тип), вирус Эпштейна-Барр (4 тип), цитомегаловирус (5 тип); вирус герпеса (6а и 6b типы), 7 тип – возможный фактор развития синдрома хронической усталости, который также провоцирует онкологические заболевания лимфоидной ткани, и наконец вирус герпеса 8 типа, поражающий лимфоциты и провоцирующий развитие саркомы Капоши, первичной лимфомы, болезни Кастлемана [4].
Коронавирусы (Coronaviridae) представляют собой большое семейство РНК-содержащих вирусов, которые могут инфицировать человека и некоторые виды животных, вызывая целый ряд нарушений: от легких форм острой респираторной инфекции до тяжелого острого респираторного синдрома (ТОРС/SARS). С 2019 года человечество пережило 7 эпидемических волн новой коронавирусной инфекции SARS-COV-2, и в настоящее время коронавирус постепенно приобретает черты сезонной вирусной респираторной инфекции [5].
Вирусы герпеса (ДНК-вирусы) и коронавирусы (РНК-вирусы) одинаково поражают клетки-мишени, высвобождают в ней свой генетический материал, продуцируют новые вирусы, разрушают клетку и поражают новые клетки организма человека. Вирусы имеют сходную продолжительность инкубационного периода: от 2 до 14 дней, преимущественно передаются воздушно-капельным или контактным путем от человека к человеку, способны вызывать острое заболевание, но также могут протекать латентно, без клинических проявлений [6-8]. Выявляется зависимость течения заболевания от текущего статуса иммунной системы, формируется нестойкий иммунитет после перенесенного заболевания как при герпетической инфекции, так и при коронавирусной инфекции. Вирус герпеса может находиться в организме человека в «спящем» состоянии всю жизнь. Обладает ли сходным свойством коронавирус, пока точно неизвестно [8]. Доказано, что вирус герпеса проявляется на фоне снижения функций иммунной системы, но и собственно вирус активно блокирует функции местного иммунитета и систему интерферонов. Попадая в организм, коронавирус вызывает сильный иммунный ответ и дисфункцию иммунной системы, подавляет синтез интерферонов [9]. Таким образом, как вирусы герпеса, так и вирус SARS-COV-2 активно нарушают функции интерферонов, подавляя противовирусную активность инфицированных и соседних клеток, модулируют врожденные иммунные реакции [8-10]. За последние четыре года у пациентов состояние, возникающее после коронавирусной инфекции с подтвержденным заражением SARS-CoV-2, либо у лиц с подозрением на коронавирусную инфекцию через 3 месяца после начала COVID-19 с длительностью симптомов не менее 2 месяцев, которое не может быть объяснено альтернативным диагнозом, получило название «Постковидного синдрома», по классификации МКБ-10 – Код U09.9 [10; 11].
Ведущими причинами развития постковидного синдрома считаются: прямое повреждение органов и систем пациента, персистенция вируса в организме, также определена роль дисфункции иммунного ответа и нейтрофильных внеклеточных ловушек. Кроме того, вирус провоцирует аутоиммунные реакции, нарушения гемостаза, развитие хронического системного воспаления [9; 11]. Следовательно, можно предположить, что при ассоциации хронической герпетической инфекции с коронавирусной инфекцией в постковидном периоде, ожидаются более выраженные клинико-иммунологические нарушения.
Цель исследования – изучить особенности клинических проявлений постковидного синдрома, ассоциированного с герпетической вирус-инфекцией Эпштейна-Барр (ВЭБ), и варианты нарушений в системе интерферонового статуса.
Материалы и методы исследования
Под динамическим наблюдением в течение 24 месяцев находились 298 пациентов в возрасте 18-64 лет, перенесших острую вирусную инфекцию SARS-COV-2 (ПЦР+) и поступивших на курс восстановительной терапии в отделение иммунологии и аллергологии Б ПНЦ РАН через 3 месяца после острых проявлений, с 2-кратным ПЦР отрицательным результатом исследования на наличие РНК вируса SARS-COV-2.
Все пациенты подписывали информированное согласие. Работа выполнена в рамках Госзадания по Программе 2023-0006, одобрена ЛЭК Б ПНЦ РАН.
Легкое течение в остром периоде коронавирусной инфекции имели 203 пациента, тяжелое течение – 95. Наряду со стандартными методами клинико-лабораторного обследования пациентов с постковидным синдромом [11], методом ПЦР проводилось исследование слизи из зева на ДНК вируса герпеса 1-2 типов, вируса Эпштейна-Барр (ВЭБ), ЦМВ, ВГЧ-6т. Методом ИФА в сыворотке крови определялась концентрация сывороточных IgM, IgG к герпетическим вирусам и IgG авидность [6; 9] для дифференцировки стадии инфекционного процесса. По данным клинического анализа крови рассчитывался нейтрофильно/лимфоцитарный индекс (НЛИ), который отражал соотношение неспецифического и специфического иммунитета [12; 13]. Референсные значения НЛИ=2,47-3,51 у.е. Исследование в сыворотке крови цитокинов TNF-α, IL-6, IL-1β, IL-8, IL-10, интерферонов INF-a и INF-γ осуществляли с использованием тестовых систем производства АО «Вектор-Бест» (Россия) на иммуноферментном анализаторе STAT FAX 3200 (Awareness Technology Inc., USA).
Статистическую обработку результатов проводили с использованием компьютерных программ Statistica 8.
Результаты исследования и их обсуждение
В клинической картине герпетической инфекции у 65,2% пациентов в постковидном периоде отмечались общеинтоксикационные симптомы: слабость, вялость, снижение работоспособности, нарушение сна, головные боли, субфебрильная температура. Со стороны органов дыхания чаще всего беспокоила одышка и тяжесть в грудной клетке – у 27,3% пациентов. Высыпания на коже туловища, конечностей наблюдались у 16,6%, лимфоаденопатия – у 6,7%, панические атаки, приступы сердцебиения – у 9,4%. Другие проявления, в частности потливость, непостоянные боли в горле, тяжесть в правом подреберье, вздутие живота, диспепсические нарушения, мигрирующие боли и дискомфорт в мышцах и суставах и др., регистрировались у 11,8% пациентов. Наиболее выраженные клинические симптомы наблюдались у пациентов, страдающих микст-герпетической вирусной инфекцией. В ранние сроки постковидного периода (через 2-3 недели) у 5,6% пациентов имело место обострение вирусной инфекции, вызванной вирусом герпеса 3 типа (Herpes Zoster). Маркерами реактивации хронической герпетической инфекции, вызванной вирусом Эпштейна-Барр (ВЭБ), явились: наличие антител ко всем антигенам вируса (VCA-IgM, EA-IgG, EBNA-IgG), индекс авидности более 50 и детекция ДНК ВЭБ, определенная методом ПЦР. При анализе полученных результатов выяснилось, что у 72,3% пациентов с моно- и микст-герпес-вирусными инфекциями доминировала инфекция, вызванная вирусом Эпштейна – Барр (ВЭБ).
В клинической картине у пациентов с ВЭБ-инфекцией наиболее значимыми были следующие симптомы: выраженная слабость, хроническая усталость, непостоянные боли в горле, мигрирующие боли и дискомфорт в мышцах и суставах, длительный субфебрилитет, частые ОРВИ, регионарная лимфоаденопатия, нарушение структуры сна и процесса засыпания, снижение памяти, внимания. Формирование патологии со стороны органов дыхания и депрессия наблюдались реже. В клиническом анализе крови у 17,3% пациентов с ВЭБ-инфекцией выявлялись: стойкая лейкопения (2,5±0,9 г/л) и стойкая лимфоцитопения (0,93±1,02 кл/мкл) – у 46,2%; умеренно выраженная анемия (106±12,9 г/л) – у 12,6%, что согласуется с данными, приведенными в исследованиях 2020-2021 гг. [14; 15]. Отмечено было также умеренное повышение СРБ – 5,82±1,02 мг/дл, АЛТ/АСТ – 48,6±9,6 / 37±6,4 мМоль/л. При исследовании цитокинового статуса сохранялось умеренное повышение уровня IL-1β – 18,3±4,7 пг/мл у 67,9% и IL-6 – 103,5±18,7 пг/мл у 59,5% [9].
Изучение функциональной способности лейкоцитов периферической крови человека продуцировать интерфероны позволяет судить об иммунореактивности организма, выявлять чувствительность клеток крови к иммуноактивным препаратам и дает возможность определить тактику лечения при разных формах патологии, прогнозировать исход заболевания. Интерфероновый статус (ИС) рассматривается в настоящее время в качестве неспецифических биомаркеров иммунопатологии человека [8; 16]. Известно, что с иммунологической точки зрения интерфероны выполняют три основные функции: активируют противовирусную защиту в инфицированных и соседних клетках, ограничивая распространение инфекции; модулируют врожденные иммунные реакции, включая презентацию антигена и функции естественных клеток-киллеров, блокируют провоспалительную активность, активируют адаптивную иммунную систему к продукции высокоаффинных антиген-специфических Т- и В-клеточных ответов [8; 16]. Наши исследования показали, что у 17,1% пациентов значения спонтанной и индуцированной продукции IFN-α и IFN-γ были в пределах референсных значений – 1-й вариант (группа 1, n = 8);
у 54,5% пациентов отмечен 2-й вариант (группа 2, n = 26), который характеризовался снижением показателей;
3-й вариант был выявлен у 8,4% (группа 3, n = 14) – значительное повышение показателей ИС (рисунок).
В рутинной клинической практике исследование гуморального, клеточного иммунитета, цитокинового и интерферонового статусов не всегда доступно для оценки состояния пациента и выбора методов иммунотерапии. Анализ показателей индуцированной продукции IFN-α и нейтрофильно/лимфоцитарного индекса позволил установить, что
при первом варианте Н/Л-индекс и индуцированный IFN-α были в пределах референсных значений (IFN-α=760± 44,24 Ед/мл и Н/ЛИ=2,99±0,76 у.е., р<0,005);
при втором варианте Н/Л-индекс был повышенным (Н/Л= 4,52±0,92 у.е.), а уровень индуцированного IFN-α оказался сниженным – 50± 4,24 Ед/мл при р<0,005;
при третьем варианте Н/Л-индекс был пониженным (2,09±0,76 у.е.), а уровень IFN-α =1240± 104,24 Ед/мл – повышенным, при р <0,005.
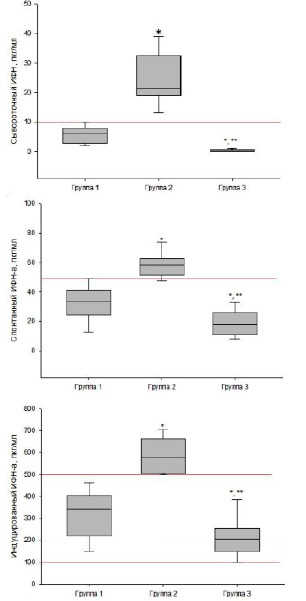
Варианты интерферонового статуса у пациентов с герпетической вирус-инфекцией Эпштейна-Барр в постковидном периоде
Группа 1 (n=8) – показатели в пределах референсных значений, группа 2 (n=26) – выше референсных значений, группа 3 (n=14) – ниже референсных значений. Красной линией обозначены референсные значения * – достоверное (p<0,05) отличие от группы 1, ** – достоверное отличие от группы 2
Прямой корреляционной зависимости между цитокинами (TNF-α, IL-6, IL-1β, IL-8, IL-10) и индуцированной продукцией IFN-α выявлено не было. Кроме того, установлено, что если в клинической картине присутствовали общие интоксикационные симптомы, то у такой группы пациентов показатели интерферонового статуса и Н/Л-индекс были в пределах референсных значений. При втором варианте регистрировался инфекционный синдром (частые ОРВИ, субфебрильная температура, лимфоаденопатия). При третьем варианте отмечались подъемы температуры до 37,7-38.0 °С без катаральных проявлений, мышечные и суставные боли, выраженная лимфоаденопатия, кожные проявления, приступы сердцебиения. Сопоставляя клиническую картину с результатами Н/Л-индекса, который легко можно рассчитать по клиническому анализу крови, разрабатывали индивидуальные программы иммунореабилитации.
Так, при 1-м варианте интерферонового ответа и при референсных значениях Н/Л-индекса назначалась стандартная реабилитация без применения иммуномодуляторов, проводилась работа с психологом, коррекция питания и водного режима, детоксикационная терапия; назначались ЛФК, массаж, общая магнитотерапия, водные процедуры. Продолжалась медикаментозная терапия (препараты базисной терапии по основному заболеванию + гипооксиданты, гепатопротекторы, нейропротекторы, витаминно-минеральный комплекс, коррекция микробиоценоза кожи, слизистых и т.д.). Медикаментозная терапия назначалась последовательно, с учетом индивидуальных клинических проявлений в постковидном периоде.
При 2-м варианте интерферонового ответа и при повышенных значениях Н/Л-индекса назначалась прежде всего детоксикационная терапия, санация хронических очагов инфекции, заместительная интерфероновая терапия, коррекция нарушенных звеньев иммунитета, оптимизация функций выделительных органов, стандартная реабилитация. Проводилась работа с психологом, коррекция питания и водного режима, назначались ЛФК, массаж, общая магнитотерапия, медикаментозная терапия (препараты базисной терапии + гипооксиданты, гепатопротекторы, нейропротекторы, витаминно-минеральный комплекс, коррекция микробиоценоза кожи, слизистых и т.д.).
При 3-м варианте интерферонового ответа, при повышенных значениях Н/Л-индекса, прежде всего проводилась активная детоксикация организма, коррекция микробиоценоза кожи и слизистых, стандартная реабилитация, работа с психологом, коррекция питания и водного режима, подбиралась индивидуальная программа ЛФК, массажа, назначались электросон, общая магнитотерапия с музыкотерапией, коррекция нарушенных функций иммунной системы.
Заключение
У пациентов в постковидном периоде чаще регистрируется активация герпетической инфекции, в структуре которой значительное место занимает ВЭБ-герпетическая инфекция. В клинической картине ВЭБ-герпетической инфекции отмечаются более выраженные симптомы интоксикации, стойкая субфебрильная температура, лимфоаденопатия и неоднозначные нарушения в системе противовирусной защиты организма, в системе интерферонового статуса. Активация хронической герпетической ВЭБ-инфекции наблюдалась при любом варианте течения острой вирусной инфекции, вызванной вирусом SARS-CoV-2, и её клинические проявления мало зависели от тяжести предшествующего инфекционного процесса. Пациенты в возрасте 60 лет и старше, имеющие коморбидные заболевания, прежде всего сахарный диабет 2-го типа, неконтролируемое течение аллергического воспаления и патологию сердечно-сосудистой системы, имели более тяжелое течение и хуже отвечали на лечение. Анализ полученных нами результатов показал, что у пациентов в постковидном периоде при активации герпетической Эпштейна-Барр вирус-инфекции (ВЭБ) развивается стойкая лимфопения и дисбаланс в интерфероновом статусе, создаются благоприятные условия для персистенции SARS-CoV-2, что может, в свою очередь, поддерживать активацию иммунной системы при долгом COVID-19.
С учетом установленных особенностей нейтрофильно/лимфоцитарного индекса и нарушений в интерфероновом статусе был разработан и успешно применён алгоритм индивидуального подхода к назначению терапии иммунотропными и противовирусными препаратами, не требующий дорогостоящих затрат как со стороны пациентов, так и системы здравоохранения, позволяющий мониторировать эффективность проводимой терапии.
Автор выражает благодарность главному научному сотруднику Института фундаментальных проблем биологии ПНЦ РАН д.б.н. Прохоренко И.Р., научному сотруднику института фундаментальных проблем биологии ПНЦ РАН Радзюкевич Я.В., ведущему специалисту стат. отдела Б ПНЦ РАН Павлик В.Д. за оказанную помощь в подготовке материала к публикации.

