До 1989 года рак щитовидной железы (ЩЖ) составляя в среднем по России менее 1% всех злокачественных новообразований, а в структуре онкологической отчетности был отнесен в рубрику «прочие злокачественные новообразования». В настоящее время, рост заболеваемости четко прослеживается во всех индустриально развитых странах и в связи с этим, подлежит детальному изучению [6,7,8,9,10].
Изучение заболеваемости населения раком ЩЖ в России стало особенно актуально после аварии на Чернобыльской АЭС, в результате которой наибольшему воздействию радиации подверглись такие области как Брянская, Орловская, Калужская, Рязанская, Белгородская [1,2]. В России заболеваемость раком ЩЖ в период с 1986-1990г. составляла 1,0 на 100 тыс. человек у мужчин и 3,85-у женщин; в период 1996-2000 г.-1,42 на 100 тыс. человек у мужчин и 7,10-у женщин [2,4,5], что согласуется и с нашими данными [3].
При этом, абсолютное число больных с впервые в жизни установленным диагнозом злокачественного новообразования ЩЖ в 2006 году составило 8582 человек Показатель заболеваемости на 100000 населения составил 6,24. За период 1996-2006 гг. прирост показателя составил 46,8%.
Особое значение при изучении данной темы имеет дальнейшее изучение инновационных методов исследования, в том числе, и морфлфункциональных, а также сопоставление их с клиническими данными, в том числе и в контексте динамики.
В связи с этим, целью нашего исследования явилось сопоставление морфологических данных, в том и числе трансмиссионная и растровая электронная микроскопия с микроэлементным и морфометрическими данными при раке ЩЖ различной степени злокачественности с клиническим прогнозом.
Материал и методы
Было выбрано 25 больных с раком ЩЖ. Электронно-микроскопические исследования проводили с использованием свежего материала, фиксированного в 2.5% растворе глутарового альдегида. Заливку образцов ткани производили в ЭПОН-812 по общепринятой методике. Полутонкие срезы окрашивали толуидиновым синим, ультратонкие срезы контрастировали ацетатом уранила и цитратом свинца и исследовали в электронном микроскопе JEM-1200EXII (Япония).
Для сканирующей электронной микроскопии образцы фиксировали в стандартном глютаральдегидовом фиксаторе и затем просматривали в растровом микроскопе FE1 Quanta 200 3D с изучением микроэлементного анализа
Результаты исследования
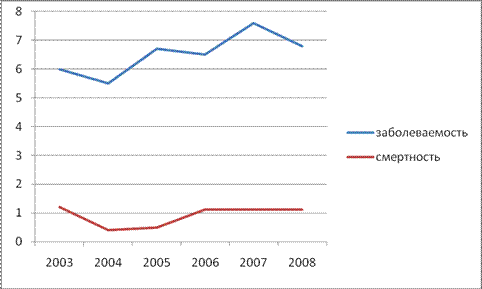
Следует отметить, что по данным Белгородского областного онкологического диспансера число больных раком ЩЖ стабилизировалось на незначительных величинах (табл. 1).
Таблица 1
Распространенность рака ЩЖ по годам на 100 000 жителей Белгородской области
Размеры опухолевых узлов в щитовидной железе варьировали от 0,7 до 4,5 см. в диаметре, в 3 случаях наблюдался мультицентрический характер роста, показатель T1-2 системы TNM отмечен в 10 наблюдениях, Т3-4 - 15 случаях. Метастазы в лимфатических узлах на момент операции наблюдались у 12 (48.0%) пациентов, при этом показатель N1а отмечен в 9 (36/0%) случаях и N1b - в 4 (12/0%) наблюдениях. Отдаленные метастазы в печени выявлены у 1 больного. Прорастание опухолью капсулы органа и прилежащей жировой клетчатки обнаружено в 14 случаях (56.0%).
При гистологическом исследовании материала опухоли щитовидной железы имели строение папиллярного рака типичного строения, папиллярного рака с участками фолликулярного строения и фолликулярного варианта папиллярного рака.
Электронномикроскопически для папиллярных раков щитовидной железы высокодифференцированных характерным является наличие клеток преимущественно цилиндрической формы. Межклеточные пространства нередко расширены и могут содержать в различном количестве ворсинки. Апикальная поверхность может быть гладкой или с наличием ворсинок различной длины. Ядра опухолевых клеток иногда округлые с хорошо выраженной бороздой и диффузным хроматином, иногда имеют глубокие инвагинации и конденсированный хроматин по периферии кариоплазмы или в виде глыбок, хаотично разбросанных по всему ядру. Цитоплазма содержит умеренное количество округлых митохондрий, фрагменты цистерн гранулярного эндоплазматического ретикулума (иногда расширенных и с мелкозернистым содержимым), рибосомы, полисомы, липидные включения и осмиофильные секреторные гранулы. Размер и количество последних колеблется от случая к случаю и в пределах одного наблюдения. Клеточные контакты представлены десмосомами и зонами замыкания. На базальной поверхности клеток определяется базальная мембрана различной толщины.
В умереннодифференцированных раках наряду с вышеописанными ультраструктурными особенностями наблюдаются клетки в незначительном количестве
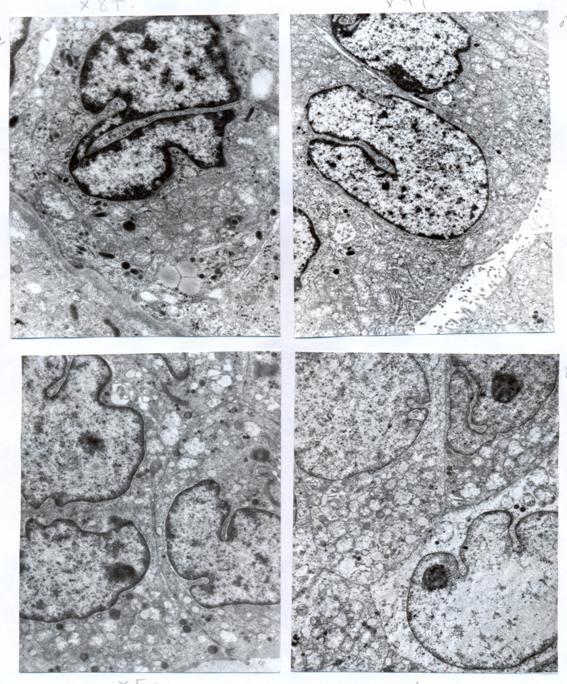
Рис. 1. Опухоли с высокой степенью ультраструктурной дифференцировки
А) Опухолевая клетка имеет характерное для папиллярных раков ядро с бороздкой, конденсированный хроматин, расположенный маргинально и в виде хаотично разбросанных глыбок по всему ядру. В цитоплазме определяются округлые митохондрии, фрагменты гранулярного эндоплазматического ретикулума, лизосомы, электронноплотные осмиофильные гранулы и липидные включения. В левом нижнем углу виден фрагмент базальной мембраны. X 8000.
Б) На апикальной поверхности опухолевых клеток имеются микроворсинки. X 4000.
В) Группа опухолевых клеток, в цитоплазме которых среди умеренного количества митохондрий видны осмиофильные секреторные гранулы. Между клетками формируется десмосомоподобный контакт. X 5000.
Г) Группа опухолевых клеток разной степени ультраструктурной дифференцировки. В правом нижнем углу клетка с незначительным количеством органелл. X 4000. с темным матриксом и грубыми ядрами с глубокими инвагинациями. Встречаются опухолевые клетки, в цитоплазме которых преобладают рибосомы и полисомы и единичные осмиофильные секреторные гранулы. Отдельные клетки имеют зоны «расплавления». Количество десмосом снижается.
Низкодифференцированные папиллярные раки представлены преимущественно клетками с незначительным количеством обычных органелл. Осмиофильные секреторные гранулы не определяются. Преобладают клетки с темным матриксом и уродливыми ядрами с конденсированным хроматином. На апикальной поверхности клеток нет ворсинок, а базальная мембрана или резко утоньшена, или отсутствует. Клеточные контакты единичные (рис. 1).
При сканирующей электронной микроскопии выявлены полиморфные клетоки неправильно-округлой формы. В отдельных случаях - это единичесные клетки. Но, в материалах с удаленной опухолью ЩЖ, это преимущественно скопления клеток от десяти до нескольких десятков. Внутри этих образований контакты между клетками представлены незначительно. Еще хуже обстоит картина их связи с другими клетками и тканями, когда контакты но своей длине превосходят. Иногда с несколько раз, скопления опухолевых клеток, а по толщине, в отдельных фрагментах, не превышают диаметр одной клетки. Следует отметить, что такие образования часто располагаются возле сосудов. Все это создает благоприятную основу для возможного метастазирования (рис. 2).

Рис. 2. Фрагмент папиллярного рака ЩЖ. Скопление опухолевых клеток при раке ЩЖ
РЭМ. Ув.х8000.
При изучении микроэлементного анализа в местах скопления опухолевых клеток видно значительное увеличение калия и фосфора, с достоверным ростом натрия и магния, что не наблюдается в других участках ЩЖ с преимущественным нахождением углерод и кислорода. Следует отметить, что различие в соотношении между микроэлементами опухолевых клеток находится в прямой зависимости от их злокачественности в низкодифференцированных раках содержание калия, фосфора и магния больше, чем в высокодифференцированных.
Таким образом, применение электронной микроскопии является качественным методом для определения степени зрелости опухоли ЩЖ для определения дальнейшего ее прогноза.
СПИСОК ЛИТЕРАТУРЫ
1. Лушников Е.Ф., Цыб А.Ф., Ясмита С. // М.: ОАО «Издательство «Медицина», 2006.
2. Павлова Т.В., Смирнова Е.А., Гуревич Л.Е., Павлов И.А. // Архив патологии. - 2008. - № 4.
3. Хаитов Р.И., Цыб А.Ф., Спасский Б.Б. // Медицинская радиология. - 1995. - № 3.
4. Хмельницкий О.К. // СПб.: Издательский дом СПбМАПО, 2003.
5. Хмельницкий О.К., Крулевский В.А., Мерабишвили В.М., Кипич А.В. // Архив патологии.- 2003. - № 2.
6. Buergy D, Weber T, Maurer GD, Mudduluru G, Medved F, Leupold JH, Brauckhoff M.// Int J Cancer. 2009 Aug 15;125(4):894-901.
7. Gaj Z, Krzeslak A, Pomorski L, Lipinska A. // Tumori. 2009 May-Jun; 95(3):352-6.
8. Cavalheiro BG, Junqueira CR, Brandão LG. // Arch Otolaryngol Head Neck Surg. 2009 Aug;135(8):812-7.
9. Post S, Dralle H, Allgayer H.// Int J Cancer. 2009 Aug 15;125(4):894-901.
10. Adler JT, Cook M, Luo Y, Pitt SC, Ju J, Li W, Shen B, Kunnimalaiyaan M, Chen H. // Mol Cancer Ther. 2009 Apr;8(4):914-20.

