Для повышения качества визуализации различных частей тела человека и животных сегодня могут быть применены различные методы лучевой диагностики с использованием лекарственных средств или устройств, обладающих контрастирующими свойствами. В частности, в настоящее время широко используются внутрисосудистое и внутриполостное введение растворов рентгеноконтрастных средств при проведении рентгенологических исследований. Однако известно, что использование рентгенологического метода лучевой диагностики с использованием рентгеноконтрастных средств может нести в себе ятрогенную угрозу живым тканям пациента [6]. Результаты исследований, проведенных в последние годы показали, что одними из самых безопасных методов лучевой диагностики являются инфракрасная термоскопия и термография, которые лишены физического воздействия на исследуемые ткани, поскольку оценивают поток инфракрасного излучения, исходящий от них [3,5]. Это обстоятельство позволяет осуществлять непрерывный и бесконтактный мониторинг с помощью тепловизора за исследуемым участком тела человека или животного, оценивая динамику изменений температуры любой поверхности во времени [9,10].
Однако традиционные методы инфракрасного мониторинга имеют существенные недостатки, поскольку позволяют получать термограмму лишь с поверхности участков тела, которые часто имеют многоцветное изображение на экране тепловизора, что существенно ограничивает возможность четко визуализировать подкожные образования, расположенные на глубине более 0,5-0,6 см. Предварительные результаты проведенных ранее исследований на теплокровных животных показали, что подкожные инфильтраты растворов лекарственных средств могут быть обнаружены в инфракрасном спектре в том случае, если обладают свойствами термоконтрастирования, то есть изменяют цвет инфракрасного изображения кожи в области инъекции по отношению к окружающим тканям [1,7].
Цель исследования – повышение качества визуализации живых тканей человека и животных при инфракрасной термоскопии и термографии за счет применения термоконтрастирующих средств.
Материалы и методы исследования
В условиях лицензированного вивария проведены наблюдения за изменением температуры кожи передней брюшной стенки 10 бодрствующих поросят в области одновременных подкожных инъекций 1 мл раствора 0,9 % натрия хлорида температурой +15ºС,+25ºС и +35ºС на расстоянии друг от друга 5 см. Для подкожных инъекций поросятам использован готовый качественный раствор для инъекций 0,9 % натрия хлорида производства ООО «Завод Медсинтез» г. Новоуральска. Инъекции препарата производились одноразовыми шприцами средним медицинским персоналом в строгом соответствии с общепринятыми технологиями при соблюдении условий асептики и дезинфекции. Инфракрасную термоскопию и термографию осуществляли с помощью тепловизора ThermoTracer TH9100XX (NEC, USA) в диапазоне температур +25 – + 36°С. Обработку полученной информации проводили с помощью компьютерных программ Thermography Explorer и Image Processor. Исследованы возможности инфракрасной визуализации образованных инъекциями растворов подкожных инфильтратов.
В клинических условиях исследована динамика изменений температуры и спектра инфракрасного излучения кожи пациентов во время ее санации растворами антисептиков и последующего инфильтрирования кожи и подкожно-жировой клетчатки растворами местных анестетиков, проводимых по общим правилам при операциях на мягких тканях передней брюшной стенки и паховой области. Также нами был проведен тепловизорный мониторинг за динамикой локальной температуры в области инъекций в подкожные вены конечностей пациентов до, во время и после введения растворов лекарственных средств.
Статистическую обработку проводили на персональном компьютере типа IBM PC марки LG LW65-P797 с использованием пакета прикладных программ STATISTICA 6.0. Статистическую достоверность оценивали путём применения t-критерия Стьюдента для непарных выборок, а проверку статистических гипотез осуществляли на уровне зависимости, равной и меньшей 0,05. План исследований был одобрен этическим комитетом Ижевской государственной медицинской академии на основании принципов, которые изложены во Всемирной Медицинской Декларации в Хельсинках.
Результаты исследования и их обсуждение
Анализ полученных данных показал, что с помощью тепловизора возможно бесконтактное получение информации об изменениях температуры и спектра инфракрасного излучения поверхности кожи над постинъекционными инфильтратами в подкожно-жировой клетчатке, а также над подкожными венами при введении в них растворов лекарственных средств.
Результаты, полученные в экспериментах на поросятах показали, что медикаментозные инфильтраты, образованные подкожным введением 1 мл раствора 0,9 % натрия хлорида с показателем температуры +15 ºС,+25 ºС и +35 ºС визуализируются в инфракрасном спектре излучения, однако их контрастирующие свойства проявляются неодинаково. Так при постоянной температуре в помещении вивария +25 ºС, средняя температура кожи передней брюшной стенки поросят составила +33,6±2,7 ºС (n=10), при этом минимальные и максимальные температурные значения составили +31,0 и +35,6 ºС соответственно, а спектр инфракрасного изображения кожи передней брюшной стенки поросят был представлен в желто-оранжево-красном спектре. Термоскопия и термография области инъекций, проведенные сразу после подкожного введения растворов показали, что наилучшими контрастирующими свойствами обладают инфильтраты, образованные введением 0,9 % натрия хлорида температурой +15 ºС, придающие инфракрасному изображению кожи над ними синий цвет и снижающий средний показатель температуры до +26,5±1,4 ºС (n=10, Р<0,05). Инфильтраты, образованные введением растворов с температурой +25ºС вызывали снижение средней температуры до 28,5±1,8 ºС (n=10, Р<0,05) и придавали инфракрасному изображению желтл-зелено-голубой цвет. «Невидимыми» в инфракрасном спектре оказались инфильтраты, образованные введением 1 мл 0,9 % натрия хлорида температурой +35 ºС, поскольку не приводили к изменению цвета инфракрасного излучения кожи над ними.
Полученные на здоровых поросятах результаты свидетельствуют о том, что наилучшими контрастирующими свойствами обладают инфильтраты, образованные «холодными» растворами, отличающимися от температуры окружающих тканей не менее, чем на 5 ºС.
Клинические наблюдения за динамикой изменений спектра инфракрасного изображения операционного поля в условиях операционной с температурой окружающего воздуха +24ºС показали, что антисептическая обработка поверхности кожи пациентов и нанесение анестетика «комнатной» температуры на ее поверхность снижают температуру кожи с 32,2±1,5 до 27,5±0,8 ºС (n=8, Р<0,05). В этих условиях для создания эффекта инфракрасного контрастирования подкожных инфильтратов, образованных локальным введением местных анестетиков, необходимо повысить до 32-33 ºС или понизить до 22-23 ºС их температуру. Однако подкожное введение «холодных» анестетиков в объемах необходимых для достижения качественного обезболивания пациента может сопровождаться локальным нарушением реологических свойств крови [2]. В то же время указаний на необходимость охлаждения или согревания местных анестетиков до 32-33ºС перед их подкожным введением пациенту отсутствует в инструкциях по их применению. Ранее было показано, что согревание антисептических растворов до 42ºС позволяет повышать их санирующие свойства [4]. Проведенные нами наблюдения показали, что обработка операционного поля «теплыми» антисептиками не снижает ее температуру и не изменяет цветность ее инфракрасного изображения. Таким образом, подкожное введение в этих условиях раствора местного анестетитка «комнатной» температуры придает ему термоконтрастирующие свойства и позволяет визуализировать его с помощью тепловизора, что позволяет контролировать направление внутритканевого распространения образуемого его подкожным введением инфильтрата, его внутритканевое расположение и размеры.
Клинические наблюдения за инфракрасным излучением поверхности рук 30 пациентов после катетеризации их подкожных вен показали, что внутривенное введение 200 мл раствора 0,9 % натрия хлорида при температуре +25°С со скоростью от 3 мл в минуту и выше обеспечивает контроль динамики перемещения раствора внутри вены. Это обусловлено тем, что введение раствора снижает теплоизлучение кожи над пунктированной веной, изменяя температуру кожи над ней с 34,8±1,1°С до 29,3±1,7°С (P ≤ 0,05, n = 30) и цветность ее инфракрасного изображения с красно-оранжевого до сине-зеленого. В том случае, если вливания охлажденного раствора произошло точно в просвет вены, то на экране тепловизора контрастируется рисунок венозного русла. При ошибочном введении лекарственного раствора, минуя просвет вены, на экране тепловизора вместо венозного рисунка появляется очаг локальной гипотермии неправильной формы.
Выявленные закономерности позволили нам разработать способ визуализации подкожных вен в инфракрасном диапазоне спектра излучения для визуализации функционирующих подкожных вен конечностей в процессе лечения тромбофлебитов или при выборе участка вены, наиболее пригодного для катетеризации. Для его осуществления проводят циркулярное сдавливание конечности выше выбранного места вплоть до прекращения оттока венозной крови от исследуемого участка, нагревание дистальной части конечности путем помещения в воду, подогретую до +42°С, вплоть до развития стойкой локальной тепловой гиперемии, охлаждение избранного участка путем прикладывания пузыря со льдом вплоть до развития стойкой холодовой гиперемии, последующее прекращение термовоздействий, укладывание и фиксирование конечности в положении, обеспечивающем визуальное наблюдение за ней, наблюдение за ее состоянием на экране тепловизора в инфракрасном диапазоне спектра излучения, обеспечивающем визуализацию термоконтрастированных вен при заполнении их теплой кровью после прекращения механического сдавливания конечности [10]. Данный способ обеспечивает безопасное бесконтактное получение «венограммы» охлажденной поверхности после притока к ней теплой крови (рис. 1).
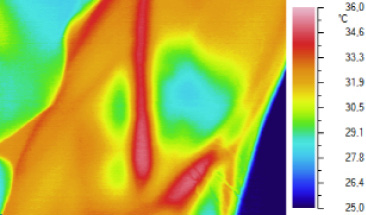
Инфракрасное изображение области локтевой ямки правой руки здорового добровольца П., 34 лет, выполненный через 60 секунд после восстановления венозного кровотока
Выводы
Инфракрасная термоскопия и термография представляют собой безопасный и бесконтактный метод лучевой визуализации живых тканей теполкровных млекопитающих. Термоконтрастирование тканей, представляющее собой искусственное понижение или повышение их температуры по сравнению с температурой окружающих тканей позволяет повышать качество тепловизионных исследований. Наилучшими термоконтрастирующими свойствами обладают жидкие лекарственные средства, кровь, а также предметы, охлаждающий или нагревающий область взаимодействия по сравнению с окружающими тканями на 5 и более градусов Цельсия.

