Во всем мире интенсивно ведутся работы по созданию литиевых источников тока, отличающихся от традиционных ХИТ максимальной теоретической и реализуемой удельной энергией. В настоящее время все высокоразвитые государства выпускают литиевые элементы различных типоразмеров. Используются литиевые элементы преимущественно в качестве источников резервного питания различных запоминающих устройств, телевизионного оборудования, высококачественной воспроизводящей аппаратуры, видеозаписи, вычислительной техники, медицинского оборудования, бытовой и специальной техники.
Одним из наиболее перспективных для использования в качестве автономных источников питания являются источники тока с жидким окислителем – тионилхлоридом. Источники тока этой системы обладают максимальной из всех разработанных источников тока удельной энергией, имеют высокое разрядное напряжение, стабильные характеристики.
Однако литий-тионилхлоридные элементы имеют ряд недостатков: в них применяется коррозионно-активный тионилхлорид, они имеют неудовлетворительную сохранность мощности, взрывоопасны.
Поведение лития в тионилхлоридных растворах LiAlCl4 заслуживает внимания, поскольку пленки, образующиеся на его поверхности, оказывают существенное влияние на стабильность литиевого электрода. В работах Дея [1-2] показано, что эта пленка является пористой и состоит из кристаллов хлорида лития. Однако устойчивость лития в тионилхлоридных растворах при длительном хранении позволила предположить [3], что под пористой пленкой, наблюдаемой под микроскопом, существует более тонкая беспористая, обладающая защитными свойствами.
Авторы работ [1,4] считают, что реакция, ведущая к начальному образованию пленки хлорида лития, может быть представлена уравнением
Li + 1/2SOCl2 = LiCl + 1/2SO.
Однако, установлено [4] , что свежеприготовленная поверхность лития немедленно покрывается оксидной пленкой (Li2O), толщина которой достигает 20–100 Ао. Поэтому необходимо учитывать процесс преобразования оксидной пленки в продукты, отвечающие составу электролита. Этот процесс представляет собой растворение или химическое взаимодействие оксида в растворителе. Результаты ренгеноспектрального микроанализа поверхности лития показали [5], что после погружения металла в раствор LiAlCl4 содержание кислорода в поверхностном слое быстро падает, при одновременном увеличении концентрации ионов хлора. Вероятно происходит следующая реакция:
Li2О + SOCl2 = 2LiCl + SO2.
Установлено [4], что эта реакция носит топохимический характер. Вначале возникают отдельные зародыши, которые затем развиваются вглубь и в стороны, постепенно замещая оксид лития и покрывая поверхность металла хлоридом.
Изучая кинетику образования пассивной пленки на литии болгарские исследователи [6], установили, что скорость ее роста в течение первых нескольких суток не зависит от концентрации раствора. Этот экспериментальный факт, а также линейная зависимость наклона Тафелевских кривых от толщины пленки позволили предположить [7], о беспористом (защитном) характере пленки с проводимостью по ионам лития. Проводимость такой пленки достигает значения (2,4 ± 0,5).10-8 Ом-1.см-1, что близко к значению проводимости соли хлорида лития [8].
Доказательством существования беспористой пленки на поверхности лития является постоянство поляризационного сопротивления электрода при изменении концентрации (сопротивления) электролита [9, 17, 18]. Дальнейшее подтверждение теория беспористой пленки получила в работах [10]. Кинетические исследования радиоактивным методом в большом диапазоне времени и температуры указали на отсутствие явной зависимости скорости роста пленки от температуры хранения образцов.
Экспериментально доказано, что поляризационное сопротивление литиевого электрода стабилизируется во времени, отмечая завершение первичной сплошной пассивирующей пленки [11], имеющей неявно кристаллическую структуру [7]. Эта пленка ведет себя как граница раздела фаз между металлом и раствором и обладает свойствами твердого электролита , пропускающего электроны [12].
Установлено [11, 13], что анодный ток в области пассивного состояния поверхности лития зависит от степени освещенности электрода, т.е. пассивирующая пленка является полупроводником, основными носителями тока в котором являются катионы лития и неосновными – электронные дырки. Концентрация неосновных носителей тока в первичной пленке мала (~1015 дырок/см3) [13] и определяет скорость дальнейшей коррозии литиевого электрода.
В работе [14] подтверждено различными методами образование на поверхности лития в тионилхлоридных растворах LiAlCl4 двойнослойной пассивирующей пленки. Показано также, что основная масса пленки состоит из хлорида лития с примесями. Скорость роста и толщина вторичной пленки зависит от объема и состава раствора LiAlCl4 , его свойств, определяющих растворимость хлористого лития. Установлено, что на толщину пленки влияют концентрация LiAlCl4 в растворе, температура электролита, избыток хлорида алюминия. При отсутствии в растворе свободного хлорида алюминия процесс коррозии лития во времени замедляется, что может служить одним из способов увеличения срока сохранности заряда в источнике тока.
Данные о скорости роста пленки на поверхности лития противоречивы. Так скорость роста пленки при температуре 70 °С достигает 0,1 мкм/час (0,3.10-10 см/с) [15]. В работе [4] приводится величина 1,4.10-10 см /с при комнатной температуре.
Зависимость толщины пленки (h) на литии от времени хранения (t) описывается уравнением: h2 = 2kt. Это уравнение хорошо описывает большое количество кинетических зависимостей, полученных в растворах с различной концентрацией и температурой. Основным признаком описанного механизма является увеличение скорости роста пленок с повышением концентрации и температуры растворов [1, 9, 16].
Пленка, образующаяся на поверхности литиевого электрода, обладает достаточно высоким электрическим сопротивлением, которое является основной причиной «провала» напряжения. К настоящему времени не установлено, каким образом происходит восстановление характеристик элемента после хранения. Предполагается [1], что пленка разрушается механически, однако в литературе отсутствуют сведения о наблюдении разрушения пленки. Вероятно, что пленка растворяется с поверхности электрода [2]. Однако, пока не установлено каков механизм растворения пленки.
Материалы и методы исследования
Коррозионные потери лития определяли гравиметрическим методом, кислотно-основным титрованием.
Образцы для коррозионных испытаний готовили из литиевой фольги размером 20х22 мм, толщиной 300–400 мкм.
Все работы по изготовлению электродов и приготовлению растворов электролитов проводили в боксе с воздухом, осушаемом фосфорным ангидридом. Технологически использование сухого воздуха наиболее удобно и экономически выгодно.
Литиевые образцы хранили в запаянных стекляных ампулах при температурах 20, 40, 60 °С. Температуру поддерживали с точностью ± 0,3 °С в специально оборудованных термошкафах
Скорость коррозии лития рассчитывали по изменению веса образцов:
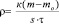 ,
,
где r – скорость коррозии, г/(м2.ч);
mо – масса образца до хранения, г;
m – масса образца после хранения, г;
s – площадь образца, м2;
t – время хранения, ч;
к – коэффициент, учитывающий нерастворимые продукты реакции. После хранения в электролите литиевый образец отмывали в тионилхлориде и в осушенном диэтиловом эфире. Затем образец растворяли в определенном объеме бидистиллированной воды. Полученный раствор гидроксида лития титровали раствором соляной кислоты в присутствии метилового оранжевого. Хлорид лития, образующийся на поверхности литиевого образца в результате коррозии, не мешает титрованию. Массу лития после коррозии определяли по формуле:
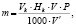
где Vk – объем кислоты, пошедший на титрование, мл;
Нk – эквивалентная концентрация кислоты, равная 0,1 н;
V – анализируемый объем раствора, мл;
V' – объем анализируемого титруемого раствора, мл.
Скорость коррозии рассчитывали по формуле:
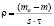 ,
,
где m о – масса образца до хранения, г;
m – масса лития после хранения, г.
Результаты исследования и их обсуждение
В таблице представлены усредненные экспериментальные данные по двум методам определения закономерностей роста пассивной пленки на литии.
Коррозионные потери (r) лития и расчетная толщина ( h ) пассивирующей пленки в зависимости от концентрации, температуры электролита LiAlCl4 и времени хранения
|
Время хранения, сутки |
Концентрация LiAlCl4, моль/л |
Температура, °С |
|||||
|
20 |
40 |
60 |
|||||
|
r, г/м2 |
h, мкм |
r, г/м2 |
h, мкм |
r, г/м2 |
h, мкм |
||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
14 |
0 |
0,23 |
0,68 |
0,33 |
0,96 |
0,35 |
1,0 |
|
0,5 |
1,82 |
5,35 |
1,93 |
5,67 |
2,05 |
6,05 |
|
|
1,0 |
1,93 |
5,70 |
2,05 |
6,05 |
2,16 |
6,37 |
|
|
1,5 |
2,16 |
6,37 |
2,27 |
6,70 |
3,52 |
9,71 |
|
|
2,0 |
2,27 |
6,70 |
2,39 |
7,05 |
3,87 |
10,39 |
|
|
60 |
0 |
0,46 |
1,23 |
0,52 |
1,36 |
0,62 |
1,39 |
|
0,5 |
2,72 |
8,06 |
3,30 |
9,74 |
3,98 |
11,74 |
|
|
1,0 |
3,41 |
10,06 |
4,55 |
13,43 |
7,04 |
20,80 |
|
|
1,5 |
4,44 |
13,07 |
5,90 |
17,44 |
7,83 |
23,14 |
|
|
2,0 |
4,55 |
13,42 |
6,60 |
19,45 |
8,53 |
25,14 |
|
|
90 |
0 |
0,45 |
1,39 |
0,56 |
1,68 |
0,69 |
1,74 |
|
0,5 |
3,07 |
9,06 |
3,97 |
11,74 |
4,88 |
14,43 |
|
|
1,0 |
3,97 |
11,74 |
5,44 |
16,08 |
7,84 |
23,14 |
|
|
1,5 |
4,99 |
14,76 |
6,93 |
20,45 |
9,31 |
27,50 |
|
|
2,0 |
5,33 |
15,76 |
7,95 |
23,46 |
10,24 |
30,19 |
|
|
120 |
0 |
0,58 |
1,68 |
0,69 |
2,01 |
0,72 |
2,07 |
|
0,5 |
3,40 |
10,06 |
4,44 |
13,07 |
5,56 |
16,44 |
|
|
1,0 |
4,20 |
12,42 |
6,13 |
18,12 |
8,29 |
24,46 |
|
|
1,5 |
5,53 |
16,43 |
7,60 |
22,26 |
10,45 |
30,84 |
|
|
2,0 |
6,02 |
17,73 |
8,87 |
26,15 |
11,35 |
33,52 |
|
|
150 |
0 |
0,68 |
2,01 |
0,72 |
2,12 |
0,79 |
2,33 |
|
0,5 |
3,74 |
11,04 |
4,90 |
14,43 |
6,16 |
18,12 |
|
|
1,0 |
4,43 |
13,07 |
6,59 |
19,45 |
8,53 |
25,14 |
|
|
1,5 |
5,90 |
16,44 |
7,96 |
23,46 |
11,27 |
33,20 |
|
|
2,0 |
6,26 |
18,44 |
8,57 |
25,23 |
12,49 |
36,89 |
|
|
180 |
0 |
0,84 |
2,15 |
0,90 |
2,67 |
0,95 |
2,68 |
|
0,5 |
3,91 |
11,94 |
4,49 |
16,66 |
6,97 |
20,08 |
|
|
1,0 |
4,49 |
13,93 |
7,34 |
21,81 |
8,82 |
25,50 |
|
|
1,5 |
6,07 |
16,67 |
8,61 |
25,14 |
12,14 |
35,56 |
|
|
2,0 |
6,44 |
18,78 |
10,35 |
29,83 |
13,15 |
37,88 |
|
Анализ экспериментальных данных показывает, что коррозионные потери лития во времени (t) возрастают по экспоненциальному закону r = tк. Константа k зависит от концентрации и температуры электролита. С повышением концентрации эта константа возрастает. Для концентраций электролита 1; 1,5; 2,0 моль/л показатель степени соответственно равен 0,289; 0,344; 0,358. Это характерно как для чистого растворителя, так и для электролита. Коррозия лития в растворах электролита значительно выше, чем в тионилхлориде. Объяснить это можно тем, что в первый момент времени между литием и тионилхлоридом происходит химическая реакция. На поверхности металла образуется пленка, предотвращаюшая дальнейшее взаимодействие лития и тионилхлорида. В дальнейшем коррозионные процессы продолжаются, видимо, по электрохимическому пути. Поскольку в тионилхлориде практически отсутствует контакт между катодными и анодными участками локализованных пар, вследствие низкой электропроводности тионилхлорида (~ 4.10-8 Ом-1.см-1 при 25 °С), электрохимический процесс коррозии протекает медленно. В растворе с концентрацией LiAlCl4 1 моль/л удельная электропроводность составляет ~ 13,0.10-3 Ом-1.см-1 при 25 °С, т.е. на 5-6 порядков выше, чем в растворителе. Естественно, что электрохимическая реакция взаимодействия между литием и тионилхлоридом в растворах LiAlCl4 протекает с более высокой скоростью, чем в чистом растворителе.
С повышением температуры потери веса лития за счет коррозии экспоненциально возрастают как в тионилхлориде, так и во всех растворах. Коррозия лития в тионилхлориде остается значительно меньше, чем в растворах соли.
Скорость коррозии лития в тионилхлоридных растворах во времени падает, но потеря массы с единицы площади возрастает. Толщина пленки также увеличивается. Наибольшую толщину имеет пленка, образовавшаяся на поверхности лития в концентрированных растворах, при повышенных температурах и длительном хранении.
Выводы
1. Установлено, что коррозия лития в растворах электролитов выше, чем в тионилхлориде.
2. Скорость коррозии лития в тионилхлоридных растворах падает во времени и возрастает с увеличением концентрации электролита и повышением температуры.

