Результат многих технологических процессов определяется скоростью и направлением кислородного обмена между объектом и атмосферой технологической камеры. Для исследований и, в конечном отчёте, оптимального управления такими процессами нужны простые, точные, пригодные в широком диапазоне условий методы непрерывного измерения скорости кислородного обмена, dM⁄dτ моль/с.
Если снабженная платиновыми электродами перегородка из плотного твердого оксидного ионного проводника (ТОИП) или суперионика на основе стабилизированной двуокиси циркония, разделяет газовые пространства с парциальными давлениями кислорода р/ и р, то при температуре несколько сот градусов на электродах такой ячейки быстро устанавливается кислородная концентрационная электродвижущая сила э.д.с.:
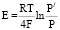 , (1)
, (1)
измеряя, которую нетрудно расcчитывать неизвестное р/[1]. Здесь R – универсальная газовая постоянная, F – число Фарадея. В нашей работе мы измеряли скорость кислородного обмена, используя концентрационную ячейку на твёрдом оксидном электролите. Реакционной камерой служило одно из электродных пространств ячейки, в котором при заданных Т и р герметизировали объект. О скорости кислородного обмена судили по изменению р, текущие значения которого рассчитывали по результатам измерения Е.
Проанализируем возможности метода. Выделение dM молей кислорода в камере объемом V вызывает приращения р и Е.
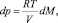 (2)
(2)
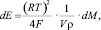 (3)
(3)
откуда получим текущее значение р, функцию преобразования и рассчётную формулу:
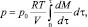 (4)
(4)
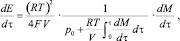 (5)
(5)
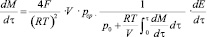 (6)
(6)
Здесь р0 и р – концентрации кислорода в камере, исходная и средняя за время исследуемого процесса. Коэффициент преобразования (чувствительность величины на входе к изменению величины на выходе) и погрешность имеют вид:
Кп = 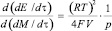 (7)
(7)
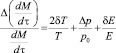 (8)
(8)
где δT/Т, δE/E и p/p0 – относительные погрешности, последняя из которых – изменение р за время исследуемого процесса. Нетрудно видеть, что диапазон условий применения метода невелик. В области окислительных атмосфер он ограничен характером зависимости Кп от р0. В области нейтральных и восстановительных атмосфер погрешность p/p0 растёт так, что метод практически не работает. Точность метода не может быть высокой, так как функция преобразования нелинейна, зависит от р и Т и включает интеграл измеряемой величины. Кроме того из-за изменения р преобразование оказывает воздействие на измеряемую величину [2, 3].
Действительно, окисляя таким образом предварительно восстановленный в водороде образец ZrO2 массой 0,08 г, при р = 0,21 атм., и Т = 920 °С, мы не обнаружили заметного изменения Е.
Здесь мы предлагаем метод, сохраняющий характерную для ТОИП абсолютную избирательность к кислороду, но свободной от недостатков метода, основанного на измерении Е.
Метод применим при любых концентрациях кислорода из диапазона, в котором ТОИП сохраняет исключительно ионную проводимость. Проще осуществлять такие измерения при атмосферном давлении и концентрации кислорода 0,21 атм. В этом случае внешний электрод ячейки не нужно изолировать от окружающей атмосферы и задача конструирования сводится к герматизации одного из электродных пространств.
Именно для таких измерений нами сконструировано измерительное устройство, показанное на рисунке. Оно состоит из станционарного корпуса и съемного центрального узла. Корпус образует внутреннее электродное пространство электрохимического преобразователя, которое служит реакционной камерой. Центральный узел служит для внесения образца во внутреннее электродное пространство.
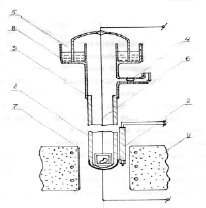
Устройство для измерения скорости кислородного обмена. 1 – пробирка из суперионика на основе стабилизированной ZrO2; 2 – термопара; 3 – стеклянная часть; 4 – затвор; 5 – стеклянный колпак; 6 – токоотвод; 7 – контейнер; 8 – уплотнитель; 9 – электропечь
Корпус включает пробирку 1, термопару 2, стеклянную часть 3 и затвор 4. Пробирка 1 из ваккуумплотной керамики состава ZrO2 + 9 моль % Y2O3 снабжена на своем закрытом конце внутренним и наружным вожженными платиновыми электродами. Пробирка образует стенки реакционной камеры и служит твёрдым оксидным электролитом преобразователя. Платина – платинородиевая термопара 2 открытым рабочим концом прикреплена к наружному электроду пробирки. Платиновая ветвь термопары служит токоотводом внешнего электрода. Стеклянная деталь 3, снабженная открытым ответвлением и заканчивающаяся кольцевыми пазом, припаяна к открытому концу пробирки. Затвор 4 представляет собой перегородку из ртути в горизонтально расположенной стеклянной трубочке – ответвлении детали 3. Затвор служит для поддержания постоянного давления в замкнутой реакционной камере при корректировании температуры.
Центральный узел включает стеклянный колпак 5, токоотвод 6 и контейнер 7. Колпак 5 является ответным по отношению к кольцевому пазу в детали 3. Уплотнителем 8 служит жидкий галлий. Платиновый токоотвод 6 внутреннего электрода вакуум плотно впаян в колпак 5. Токоотвод 6 подсоединяется к платиновой ветви термопары 2 через низкоомный малоинерционный измеритель постоянного тока Р – 341.
Устройство снабжено цилиндрической электрической печью сопротивления 9, которая обеспечивает изотермический нагрев рабочей зоны, включающей закрытый конец пробирки с электродами и контейнер с образцом.
Поскольку твёрдый электролит – единственная электропроводящая стенка замкнутого электродного пространства, мы измеряем полный ток через замкнутую поверхность.
= V·diϑj = – V 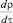 (9)
(9)
где ρ – плотность заряда, τ – плотность тока. Ток протекает, когда образец выделяет или поглощает кислород, если на электродах существуют условия для его ионизации и деионизации, обеспечивающие возможность превращения потока молекулярного кислорода в поток ионов через твёрдый электролит и далее, в электронный ток внешней цепи.
Поскольку носителями в ZrO2 являются ионы 02-, перенос Vdρ соответствует переносу Vdρ/4F молей кислорода. Функция преобразования и расчетная формула в этом случае имеют вид
= 4FdM/dτ (10)
dM/dτ = /4F (11)
а коэффициент преобразования и погрешность отвечают выражениям
Кп = 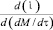 = 4F (12)
= 4F (12)
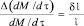 (13)
(13)
где δ/ – относительная погрешность измерения тока. Выгодный характер функции преобразования очевиден. Она линейна и не зависит от р и Т, поэтому ни погрешность, ни коэффициент преобразования практически не зависят от условий измерения. Ток которого замыкания кроме информации о скорости кислородного обмена обеспечивает постоянство исходной концентрации кислорода в газе, участвующем в исследуемой реакции. Благодаря этому преобразование практически не оказывает обратного воздействия на измеряемую величину и метод обладает высокой точностью, во всем диапазоне концентрации кислорода в газе.
В результате метод пригоден для исследования высокотемпературных процессов, проводимых в окислительных, нейтральных и восстановительных атмосферах. При осуществлении метода важно, чтобы превращение потока молекулярного кислорода в поток ионов через твёрдый электролит и, далее, в электронный ток внешней цепи происходил практически безынерционно по отношению к исследуемому кислородному обмену [4, 5].
Предложенным методом исследовали окисление поликристаллического образца ВаТіО3 + 15 ат %Ce, массой 0,005 г при Т = 900 °С, р = 0,21 атм. Наблюдали поглощение кислорода образцом в течение 20 мин., со скоростью, монотонно убывающей от 2·10-10 до 0 моль/с. (Расчетная погрешность измерения составляла 1,5 %, систематическая ошибка, обусловленная фоновым термотоком, оставалась в пределах 10 %).
Исследовали окисление предварительно восстановленного в атмосфере водорода поликристаллического образца ZrO2 + 9 моль %Y2O3 массой 0,008 г., при Т = 920 °С, р = 0,21 атм. Скорость поглощения кислорода образцом монотонно убывала в течение 1 часа от 1,05·10-10 до 0 моль/с, суммарное поглощение составило 6,35·10-8 моля. Рассчитали, что избыточные вакансии, связанные с восстановлением, составляли 0,1 % от общего количества кислородных узлов.

